
题目列表(包括答案和解析)
29.已知: (苯胺,易被氧化)
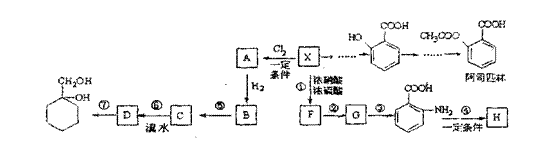 某芳香烃X(C7H8)是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种高分子化合物。
某芳香烃X(C7H8)是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种高分子化合物。
请回答下列问题:
(1)写出结构简式:H ,D 。
(2)写出反应类型:反应② ,反应④ 。
(3)写出反应⑦的条件: 。
 (4)写出反应⑤的化学方程式
;
(4)写出反应⑤的化学方程式
;
 写出
与NaOH(aq)反应的化学方程式
。
写出
与NaOH(aq)反应的化学方程式
。
(5) 有多种同分异构体,其中属于芳香族化合物的同分异构体不可能为 。
A.醇 B.醛 C.酯 D.酮 E.羧酸
28. 化学式为C8H1018O的化合物A具有如下性质:
化学式为C8H1018O的化合物A具有如下性质:
请回答下列问题:
(1)关于A的说法正确的是 。
a.A中一定含有羟基 b.A属于芳香烃
c.A属于芳香族化合物 d.A能够与氢氧化钠溶液反应
(2)写出反应类型:反应① 反应③ 。
(3)写出结构简式:C E 。
(4)写出反应②的化学方程式(注明18O的位置) 。
 (5)与A互为同分异构体,且能与NaOH溶液反应,苯环上的一溴代物只有两种的物质有
种,写出其中一种的结构简式
。
(5)与A互为同分异构体,且能与NaOH溶液反应,苯环上的一溴代物只有两种的物质有
种,写出其中一种的结构简式
。
27. 为了完成一项研究项目,需要22.4L(S.P.T.)SO2.化学小组同学依据化学方程式:
为了完成一项研究项目,需要22.4L(S.P.T.)SO2.化学小组同学依据化学方程式:
 Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O
Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O
取65.0g锌粒与98%的浓H2SO4110mL(ρ=1.84g/cm3)充分反应,锌粒全部溶解后,收集所得气体(X)经检验存在严重质量问题。
(1)推测:化学小组制得的气体中可能混有的杂质气体主要是 (填分子式):产生杂质的主要原因是: 。
 (2)实验验证:化学小组的同学设计了如图装置,对退回的气体(X)取样进行认真探究(假设气体均能被完全吸收)/
(2)实验验证:化学小组的同学设计了如图装置,对退回的气体(X)取样进行认真探究(假设气体均能被完全吸收)/
①连接好装置后,必要的一个操作是 。
②C中加入的试剂是: ,作用为: 。
③证实气体x中混有主要杂质气体的实验现象是:
D中: ,E中: 。
(3)结果处理:通入一定量的X气体,使B装置中酸性KmnO4溶液(200mL、0.20mol/L)恰好褪色;D装置实验前后质量变化1.6g。则X气体中SO2的体积分数为 。
26. 某种粗盐中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质。某同学在实验室中设计了用这种粗盐制备糖盐的方案如下(用于沉淀的试剂稍过量):
某种粗盐中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质。某同学在实验室中设计了用这种粗盐制备糖盐的方案如下(用于沉淀的试剂稍过量):
请回答以下问题:
(1)为相应操作选择所需仪器(用标号字母填写):操作I ;操作IV 。
A.烧杯 B.托盘天平 C.电子天平 D.试管 E.玻璃棒
F.分液漏斗 G.漏斗 H.泥三角 I.酒精灯 J.蒸发皿
(2)操作III中常用Na2CO3(aq)、NaOH(aq)、BaCl2(aq)作为除杂试剂,则加入除杂试剂的顺序为: N OH(aq)→ → 。
写除去Fe3+的离子方程式: 。
(3)操作III中,判断加入BaCl2已过量的方法是: 。
(4)操作V应选择的酸是: 。若将操作V与操作IV的先后顺序对调,将会对实验结果产生的影响是: 。
(5)操作VI是: 。(选择合理操作的名称,用标号字母按操作先后顺序填写)。
(a)过滤、洗涤 (b)蒸发、浓缩 (c)萃取、分液 (d)冷却、结昌
25. 在2L密闭容器内,800℃时发生如下反应:2CuO(S)+CO(g) Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
在2L密闭容器内,800℃时发生如下反应:2CuO(S)+CO(g) Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
|
时间(min) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(CuO)(mol) |
0.080 |
0.060 |
0.040 |
0.020 |
0.020 |
0.020 |
 (1)写出该反应的平衡常数表达式
。
(1)写出该反应的平衡常数表达式
。
已知:K(400℃)>K(350℃),则该反
应是 热反应。
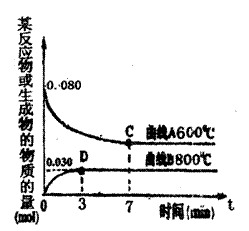
(2)右图中表示Cu2O的物质的量随时间变化
的曲线是 。(选填“A”或“B”)
800℃时,0~3s内该反应的平均速率
v(CO2)= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(CO)=v(CO2)
b.容器内压强保持不变
c.v逆(CO)=v正(CO2)
d.容器内气体的密度保持不变
(4)能使该反应的正反应速率增大,且平衡向正反应方向移动的是 。
a.增加CuO的量 b.适当升高温度
c.及时移去CO2 d.增大CO的浓度
e.选择高效催化剂 f.增大压强
24.某反应体系中的物质有:Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O。已知K2S2O8的氧化性比K2Cr2O7强。
(1)请将以上反应物与生成物分别填入以下空格内。






 +
+
+
+
+
+
+
+
(2)反应中,被还原的物质是 ,得到1mol氧化产物,转移电子 个。
(3)请将氧化剂与还原剂的化学式及配平后的系数填入下列空格中:




+ +……
(4)在酸性条件下K2Cr2O7与草酸(H2C2O4)反应的产物是:Cr2(SO4)3、CO2、K2SO4和H2O,则还原剂与氧化剂物质的量之比为 。
23.四种短周期元素的性质或结构信息如下表,请根据信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质或结构信息 |
单质温温下为固体,难溶于水易于溶CS2。能形成2种二元含氧酸。 |
原子的M层有1个未成对的p电子。核外p电子总数大于7。 |
单质曾被称为“银色的金子”。与锂形成的合金常用于航天飞行器。单质能溶强酸和强碱。 |
原子核外 电子层上s电子总数比p电子总数少2个。单质和氧化物均为空间 网状晶体,具有很高的熔、沸点。 |
(1)A原子的最外层电子排布式 ,D原子共有 种不同运动状态的电子。
(2)写出C单质与强碱反应的离子方程式 。
B与C形成的化合物溶于水后,溶液的pH 7(填“大于”、“等于”或“小于”)。
(3)A,B两元素的氢化物分子中键能较小的是 ;分子较稳定的是 。(填分子式)
(4)E、D同主族,位于短周期。它们的最高价氧化物中熔点较低的是
22.在100mL HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为
( )
A.0.225mol/L B.0.30mol/L C.0.36mol/L D.0.45mol/L
第Ⅱ卷(共84分)
答第II卷前务必将学校、班级、姓名、学生考试编号等项目内容在答题纸密封线内的相应位置上填写清楚。答题时请用钢笔或圆珠笔将答案填写在答题纸上,注意试题题号和答题纸上的编号一一对应,不能错位。答案写在试卷上一律不给分。
21. 下列气体实验中,正确的是 ( )
下列气体实验中,正确的是 ( )
 A.铜和稀硝酸制一氧化氮气体 B.加热Cu(NO3)2(s)获取NO2(g)
A.铜和稀硝酸制一氧化氮气体 B.加热Cu(NO3)2(s)获取NO2(g)
C.浓硫酸滴入浓盐酸中制HCl D.硫化氢气体的干燥与收集
20.t℃时,某浓度氯化铵溶液的pH=4,下列说法中一定正确的是 ( )
A.由水电离出的c(OH-)为1×10-10mol/L
B.溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.溶液中c(H+)·c(OH-)=1×10-14
D.溶液中c(NH3·H2O)+c(NH4+)=c(Cl-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com