
题目列表(包括答案和解析)
18.向足量H2SO4溶液中加入100mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol·L-1 HCl溶液时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为 ( )
A.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-2.92kJ·mol-1
B.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-0.72kJ·mol-1
C.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-73kJ·mol-1
D.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-18kJ·mol-1
第Ⅱ卷(共56分)
17.下列结论均出自《实验化学》中的实验,其中错误的是 ( )
A.往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘。
B.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据。
C.制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干。
D.提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量。
16.强电解质Ag2CrO4(M=331.8g·mol-1)的溶解度是0.0216g·L-1,则其浓度积Ksp为( )
A.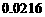 B.
B.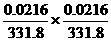
C.0.02162×0.0216
D.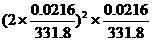
15.以多孔铂为电极,在右图装置中分别在两极区通入
CH3OH和O2,发生反应产生电流,经测定,电流
方向由b到a,下列叙述中正确的是 ( )
A.A处通入O2
B.溶液中的阳离子向a极运动
C.负极的电极反应为:2CH3OH+16OH--12e-=2CO32-+12H2O
D.b极是该燃料电池的负极
14.以下物质间的转化中,其中有不能通过一步反应实现的是 ( )
A.Al - Al2O3 - Al(OH)3 - NaAlO2
B.Fe - FeCl2 - Fe(OH)2 - Fe(OH)3
C.S - SO2 - H2SO4 - MgSO4
 D.N2 - NO - NO2 - HNO3
D.N2 - NO - NO2 - HNO3
13.下列说法正确的是 ( )
A.ⅦA族元素的非金属性一定比ⅥA族元素的非金属性强
B.第三周期元素的阳离子半径从左到右逐渐减小
C.ⅥA族元素的氢化物中,因为H2O的沸点最高,所以其稳定性也最好
D.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
12.已知反应10AgF+5Cl2+5H2O=9AgCl+AgClO3+10HF+O2,则有1molO2生成时反应所转移的电子总数为 ( )
A.4mol B.9mol C.10mol D.5mol
11.在5 mL 0.1 mol·L-1KI溶液中滴加0.1 mol·L-1FeCl3溶液5~6滴后,再进行下列实验,其中可证明FeCl3溶液和KI溶液的反应是可逆反应的实验是 ( )
A.再滴加AgNO3溶液,观察是否有AgI沉淀产生
B.加入CCl4振荡后,观察下层液体颜色
C.加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生
D.加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色
10.常温下,溶液中可发生以下反应:
①2M2+ + R2 = 2M3+ + 2R-,
②2R- + Z2 = R2 + 2Z-,
③W2 + 2Z-= 2W- + Z2;由此判断下列说法错误的是 ( )
A.常温下反应2M2+ + Z2 == 2M3+ + 2Z-可以自发进行
B.Z元素在反应②中被还原,在③中被氧化
C.氧化性强弱顺序为:W2< Z2 < R2 < M3+
D.还原性强弱顺序为: W-< Z- < R- < M2+
9.下列各项所述的两个量,前者一定大于(或高于)后者的是 ( )
A.Cl2和Br2的沸点
B.H-和H+的离子半径
C.同温下分别在100g水中最多能溶解的无水CuSO4的质量和CuSO4·5H2O的质量
D.在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com