
题目列表(包括答案和解析)
2. 3 矿物燃料(第一课时)
3 矿物燃料(第一课时)

 [课堂练习]:
[课堂练习]:
13、

 将二氧化碳气体通入氢氧化钠溶液中时没有明显的现象变化,它们之间是否发生了化学反应呢?我市某中学研究性学习小组设计了下列实验装置(所有装置气密性已检查)进行实验,通过观察到的实验现象来间接证明二氧化碳与氢氧化钠发生了化学反应。
将二氧化碳气体通入氢氧化钠溶液中时没有明显的现象变化,它们之间是否发生了化学反应呢?我市某中学研究性学习小组设计了下列实验装置(所有装置气密性已检查)进行实验,通过观察到的实验现象来间接证明二氧化碳与氢氧化钠发生了化学反应。






 试根据实验装置和相应实验操作,填写观察到的现象:
试根据实验装置和相应实验操作,填写观察到的现象:
|
装置 |
实验操作 |
实验现象 |
实验结论 |
|
A |
将充满CO2的试管倒扣在水中 |
试管内液面略有上升 |
CO2能溶于水 |
|
B |
将充满CO2的试管倒扣在NaOH溶液中 |
▲ |
CO2和NaOH发生了化学反应 |
|
C |
将NaOH溶液滴入烧瓶 |
▲ |
|
|
D |
将NaOH溶液滴入锥形瓶 |
▲ |
|
|
E |
将胶头滴管中的NaOH溶液挤入烧瓶 |
▲ |




12、

 (8分)甲、乙两同学利用下面装置测定铜和氧化铜的混合物中铜元素的质量分数。回答问题:
(8分)甲、乙两同学利用下面装置测定铜和氧化铜的混合物中铜元素的质量分数。回答问题:










 ①A中发生的化学方程式
▲
。
①A中发生的化学方程式
▲
。


 ②B装置作用 ▲ 。
②B装置作用 ▲ 。


 ③D装置中铜和氧化铜总质量为10克,充分反应后,欲求原混合物中铜元素的质量分数,还需要的实验数据是 ▲
。
③D装置中铜和氧化铜总质量为10克,充分反应后,欲求原混合物中铜元素的质量分数,还需要的实验数据是 ▲
。


 ④F装置的作用是吸收空气中的水,如果没有F装置,会使实验结果 ▲(偏大、偏小)。
④F装置的作用是吸收空气中的水,如果没有F装置,会使实验结果 ▲(偏大、偏小)。
11、

 (8分)
(8分)


 实验中学同学开展复分解反应研究性学习,设计了如下研究性学习思路:
实验中学同学开展复分解反应研究性学习,设计了如下研究性学习思路:


 [练习质疑]下列各组物质间均能反应,写出③、④反应的化学方程式。
[练习质疑]下列各组物质间均能反应,写出③、④反应的化学方程式。
①


 氢氧化钠溶液与盐酸 ②碳酸钠溶液与硫酸
氢氧化钠溶液与盐酸 ②碳酸钠溶液与硫酸


 ③硫酸铜溶液和氢氧化钠溶液 ▲ 。④碳酸钠溶液和氯化钡溶液 ▲ 。
③硫酸铜溶液和氢氧化钠溶液 ▲ 。④碳酸钠溶液和氯化钡溶液 ▲ 。


 [研究讨论]上述反应为什么能够发生?是因为这些反应物中含有特殊的阴、阳离子,如①中有H+和OH- ,②中有H+和CO32-,③中有 ▲ ,④中有 ▲ 。
[研究讨论]上述反应为什么能够发生?是因为这些反应物中含有特殊的阴、阳离子,如①中有H+和OH- ,②中有H+和CO32-,③中有 ▲ ,④中有 ▲ 。


 [构建网络]按照一定的顺序排列这些离子,就可以形成一种网络形式。在网络中,用短线相连的这些阴、阳离子能两两结合生成沉淀或气体或水。现有Ca2+、SO42-、NH4+,请将它们填入下面合适的“( )”中,使其形成一个更为完整的复分解反应网络。
[构建网络]按照一定的顺序排列这些离子,就可以形成一种网络形式。在网络中,用短线相连的这些阴、阳离子能两两结合生成沉淀或气体或水。现有Ca2+、SO42-、NH4+,请将它们填入下面合适的“( )”中,使其形成一个更为完整的复分解反应网络。






 [拓展运用]通过形成的网络,可以判断化合物间能否共存,进行物质的鉴别,用于物质的除杂等。如硫酸钠溶液混有硫酸铵,可以加入 ▲ (填写化学式)除去硫酸铵。
[拓展运用]通过形成的网络,可以判断化合物间能否共存,进行物质的鉴别,用于物质的除杂等。如硫酸钠溶液混有硫酸铵,可以加入 ▲ (填写化学式)除去硫酸铵。
10、

 有资料显示:禽流感病毒在高温、碱性环境(如氢氧化钠溶液)、高锰酸钾或次氯酸钠等消毒剂中生存能力差。次氯酸钠[NaClO]属于
( )
有资料显示:禽流感病毒在高温、碱性环境(如氢氧化钠溶液)、高锰酸钾或次氯酸钠等消毒剂中生存能力差。次氯酸钠[NaClO]属于
( )


 A.氧化物
B. 酸
C. 碱
D.盐
A.氧化物
B. 酸
C. 碱
D.盐
9、

 (5分) 某生在实验室发现一没有瓶塞的试剂瓶,里面装有白色固体试剂,瓶上标签已经严重腐蚀,看不清上面的字迹,但可以判断里面所盛试剂由三种元素组成。为确定该白色固体的成分,他取少量该固体配成无色溶液A,然后进行了以下实验:
(5分) 某生在实验室发现一没有瓶塞的试剂瓶,里面装有白色固体试剂,瓶上标签已经严重腐蚀,看不清上面的字迹,但可以判断里面所盛试剂由三种元素组成。为确定该白色固体的成分,他取少量该固体配成无色溶液A,然后进行了以下实验:






 (1)无色试剂B是 (填名称),白色沉淀是 (填化学式)
(1)无色试剂B是 (填名称),白色沉淀是 (填化学式)


 (2)若无色溶液D中只含一种溶质NaCl(不考虑前面加入的B试剂),则无色溶液A中一 定 含有
。(填化学式)
(2)若无色溶液D中只含一种溶质NaCl(不考虑前面加入的B试剂),则无色溶液A中一 定 含有
。(填化学式)
8、

 (8分)已知某纯碱试样中含有杂质氯化钠,为测定试样中纯碱的质量分数,可用下图装置进行实验。主要步骤如下,请填空:
(8分)已知某纯碱试样中含有杂质氯化钠,为测定试样中纯碱的质量分数,可用下图装置进行实验。主要步骤如下,请填空:


 ① 按图组装仪器,并检查__________________;②
将10 g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;③
称量盛有碱石灰的U形管的质量为300 g;④ 从分液漏斗中滴入20%的稀硫酸,直到________________为止,写出反应的化学方程式__________________________;⑤ 从导管A处缓缓鼓入一定量的空气;⑥
再次称量盛有碱石灰的U形管的质量;⑦ 重复⑤和⑥的操作,直到U形管的质量基本不变,测得质量为303.3 g。
① 按图组装仪器,并检查__________________;②
将10 g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;③
称量盛有碱石灰的U形管的质量为300 g;④ 从分液漏斗中滴入20%的稀硫酸,直到________________为止,写出反应的化学方程式__________________________;⑤ 从导管A处缓缓鼓入一定量的空气;⑥
再次称量盛有碱石灰的U形管的质量;⑦ 重复⑤和⑥的操作,直到U形管的质量基本不变,测得质量为303.3 g。


 回答下列问题:
回答下列问题:


 (1)装置中浓硫酸的作用是___________________________________。
(1)装置中浓硫酸的作用是___________________________________。


 (2)步骤⑤的目的是_________________________________________。
(2)步骤⑤的目的是_________________________________________。


 (3)试样中纯碱的质量分数为_________________________________。
(3)试样中纯碱的质量分数为_________________________________。


 (4)分液漏斗中的稀H2SO4不能换成浓盐酸,理由是______________________________。
(4)分液漏斗中的稀H2SO4不能换成浓盐酸,理由是______________________________。


 (5)若用生成沉淀的方法来测定试样中纯碱的质量分数,应选用的试剂是____________。
(5)若用生成沉淀的方法来测定试样中纯碱的质量分数,应选用的试剂是____________。
7、

 (4分)现欲探究一固体混合物A的成分,已知其中可能含有Mg(OH)2、CuCl2、NH4NO3、 (NH4)2SO4、
CuO五种物质中的两种或多种。按图所示进行实验,出现的现象如图所示(设过程中所有可能发生的反应均恰好完全反应)。试根据实验过程和发生的现象填写以下空白:
(4分)现欲探究一固体混合物A的成分,已知其中可能含有Mg(OH)2、CuCl2、NH4NO3、 (NH4)2SO4、
CuO五种物质中的两种或多种。按图所示进行实验,出现的现象如图所示(设过程中所有可能发生的反应均恰好完全反应)。试根据实验过程和发生的现象填写以下空白:











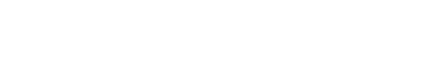








 (1)产生的气体B的气味为
。
(1)产生的气体B的气味为
。


 (2)溶液G中,一定存在的溶质是(写化学式)
。
(2)溶液G中,一定存在的溶质是(写化学式)
。


 (3)混合物A中,肯定存在的物质是(写化学式)
。
(3)混合物A中,肯定存在的物质是(写化学式)
。


 (4)写出实验过程④中可能发生的化学反应中的1个化学方程式(只能写1个,多写该空不得分):
。
(4)写出实验过程④中可能发生的化学反应中的1个化学方程式(只能写1个,多写该空不得分):
。
6、

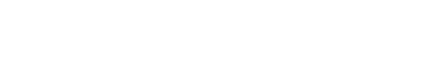
 下列装置能达到对应实验目的的是
(
)
下列装置能达到对应实验目的的是
(
)





















5、

 (6分)某同学在做实验时发现盛放NaOH溶液的试剂瓶口与橡皮塞上常有白色粉末出现,为探究这一白色粉末的成分,他做了以下实验:
(6分)某同学在做实验时发现盛放NaOH溶液的试剂瓶口与橡皮塞上常有白色粉末出现,为探究这一白色粉末的成分,他做了以下实验:


 (1)取少量白色粉末于试管中,再滴加稀HCl,有气泡产生,由此可推出白色粉末中含有
(1)取少量白色粉末于试管中,再滴加稀HCl,有气泡产生,由此可推出白色粉末中含有


 ▲
。
▲
。


 (2)该同学为进一步探究白色粉末是否含有NaOH,设计了如下实验方案:
(2)该同学为进一步探究白色粉末是否含有NaOH,设计了如下实验方案:


















 ①沉淀B的化学式为
▲
。
①沉淀B的化学式为
▲
。


 ②在操作2中,除要用到铁架台(带铁圈)、烧杯、滤纸、玻璃棒外,还需补充的玻璃仪器是 ▲
;操作2中玻璃棒的作用是 ▲
②在操作2中,除要用到铁架台(带铁圈)、烧杯、滤纸、玻璃棒外,还需补充的玻璃仪器是 ▲
;操作2中玻璃棒的作用是 ▲


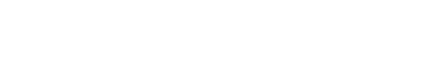 ③你认为该同学的这个方案是否正确? ▲ (填“正确”或“不正确”),理由是: ▲ 。
③你认为该同学的这个方案是否正确? ▲ (填“正确”或“不正确”),理由是: ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com