
题目列表(包括答案和解析)
17.(12分)下图是一些常见元素的单质或化合物之间的转化关系。溶液中的水以及部分反
应物或生成物未标出。A是空气中的主要成分,C是由两种元素组成的新型材料,M元索在C中占65.9%,D是一种单质。反应③、④、⑤用于工业中生产N。回答下列问题:
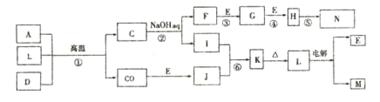
(1)写出F的二种用途:_____________________(2分)
(2)写出反应②的化学方程式:______________________(2分){
反应⑥的离予方程式;__________________________(2分)
(3)物质C和SiC的纳米级复合粉末是新一代大规模集成电路理想的散热材料。写也反
应①的化学方程式:______________________________(3分)
(4)已知灼烧lmolK生成气态水时吸收87.7kJ的热量,试写出该反应的热化学方程式:
_________________________(3分)
1 8.(15分)(1)以铅蓄电池为电源,插人惰性电极,电解稀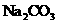 溶液。电解一段时间后,溶液中无晶体析出,下列判断正确的是________________(3分)
溶液。电解一段时间后,溶液中无晶体析出,下列判断正确的是________________(3分)
A.溶液的浓度增大
B溶液的pH增大 -
c.溶液中钠离子与碳酸根离子的比变大
D.溶液中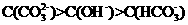
(2)铅蓄电池放电时,当外电路通过1 mol电子时,理论上负极板的质量增加__________g
(2分);电解液中 的浓度将变___________(2分)。
的浓度将变___________(2分)。
(3)废旧电池所造成的污染是严重的。下图是从废旧铅蓄电池中制取铅系列化工产品的
部分流程图。渣泥中含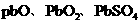 等;Pb有+2和+4价,十2的Pb稳定;
等;Pb有+2和+4价,十2的Pb稳定; 在高温、高氯离子浓度的溶液中具有较大的溶解度。根据流程图回答下列问题:
在高温、高氯离子浓度的溶液中具有较大的溶解度。根据流程图回答下列问题:
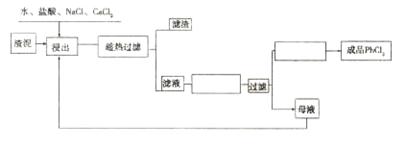
①写出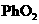 氧化盐酸反应的化学方程式:_________________________(2分)
氧化盐酸反应的化学方程式:_________________________(2分)
②“趁热过滤”的原因:____________________(2分)
③母液中溶质的成分:(写出化学式)_______________________(2分)
④在流程图中的空格内填写相应的操作。(各1分)
16.(12分)为探究同周期元索性质递变规律.设计如下实验方案,并记录了有关实验现象。
I.实验方案
①用砂纸擦净的镁带与沸水反应,再向反应液中滴加酚酞试液②向新制的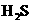 饱和溶液中滴加新制的氯水③钠与滴有酚酞试液的冷水反应④镁带与2 mol·
饱和溶液中滴加新制的氯水③钠与滴有酚酞试液的冷水反应④镁带与2 mol·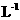 的盐酸反应⑤铝条
的盐酸反应⑤铝条
(已用砂纸打磨)与2 mol·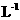 的盐酸反应⑥向氯化铝溶液中滴加NaOH溶液
的盐酸反应⑥向氯化铝溶液中滴加NaOH溶液
Ⅱ.实验现象
A.浮于水面,熔成小球,在水面上无定向移动,随之消失.溶液变红色
B.产生气体,可在空气中燃烧,溶液变成浅红色 -
C.反应剧烈,产生气体可燃烧
D.剧烈反应,产生气体能在空气中燃烧
E.生成白色沉淀,继而沉淀消失
F.生成淡黄色沉淀。
(1)据上述信息在下列空格内填写相关内容
实验方案顺序:③ ①
① ④
④ ⑤
⑤ ⑥
⑥ ②
②
对应实验现象;__________
 _______________
_______________  ______________
______________ ___________________
___________________ _________
_________  ________ (3分)
________ (3分)
(2)①实验结论______________。(3分)
②请你补充一组实验方案(简单易行),证明此周期中另外两种元索性质的递变规律
____________________________________________________________________ (2分)
(3)x、Y、z是由短周期元素组成的化台物.X为漂白液的有效成份;Y为同主族两种元
素组成的且可用来漂白纸浆、毛,丝等;Z是由四种元索组成的酸,它对应的钾盐可用于检验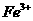
①写出Z的电予式(台叁键)__________________(2分)
②将Y通人到x的溶液中,写出离子方程式;__________________________(2分)
15.高温下,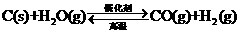 ,反应达到平衡。恒容时,温度升高.
,反应达到平衡。恒容时,温度升高.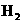 浓度增大。下列说法正确的是( )
浓度增大。下列说法正确的是( )
A.该反应焓变为正渣 .
B.升高温度,混合气体的平均摩尔质量减小
c.升高温度,逆反应速率减小,正反应速率增大,平衡向正方向移动
D.若恒容时该混合气体的密度变大了,平衡向左移动
14.将1 7.6g
Fe和Cu的混合物投入100mL13mol/L的热浓硝酸溶液中,固体全部溶解;反应后忽略溶液体积的变化测得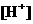 为lmol/L,
为lmol/L,  为9 mol/L。将产生的NO、
为9 mol/L。将产生的NO、 混合气体充满烧瓶A,将其倒立在水槽里,去塞后再通人4.48L氧气(标况),水恰好充满烧瓶
混合气体充满烧瓶A,将其倒立在水槽里,去塞后再通人4.48L氧气(标况),水恰好充满烧瓶
A,下列判断正确的是( )
A.反应后的溶液中金属阳离子有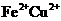
B.Fe和Cu失去的电子的物质的量为0.6mol
C.反应后的溶液中金属阳离子有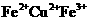
D.烧瓶A中溶液的物质的量浓度为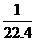 mo1/L
mo1/L
13。下列关于氢氧化钠与醋酸两种稀溶液的说法正确的是( )
A.相同浓度的两溶液中由水电离出的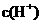 相同
相同
B.pH=12与Ph=2的两溶液稀释100倍,pH都变化2个单位
C.用20mL0.1mol/L的氢氧化钠滴定未知浓度的醋酸,选用酚酞为指示剂
D.两溶液相互反应生成1
mol 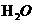 的中和热为57.3KJ/mol
的中和热为57.3KJ/mol
11.以下几种叙述,其中错误的是( )
A.一定温度下,酸、碱、盐的稀溶液中 乘积相等,即水的离子积是一个常数
乘积相等,即水的离子积是一个常数
B.某水溶液由于条件的改变,如果氢氧根离子浓度变小,则氢离子浓度一定变大
c.pH均为4的氯化铵和盐酸溶液中,水电离出的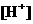 浓度之比为
浓度之比为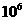
D.若溶液中阳离子有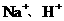 ,阴离子有
,阴离子有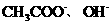 且
且 则
则
溶液是 和
和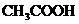 的混合液
的混合液
l 2.靠一组镍氢电池驱动.一台试运行的混合动力公交车两年内跑了十万公里,大功率镍氢动力电池及管理模块是国家”十五”863计划电动汽车重大专项中一项重要课题。常见氢镍电池的某极是储氢合金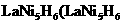 中各元素的化合价均为零)电池反应通常表示为;
中各元素的化合价均为零)电池反应通常表示为; ,下列说法正确的是( )
,下列说法正确的是( )
A.放电时储氢合金作正极
B.充电时诸氢合金作阳极
C.充电时阳极周围 增大
增大
D.放电时负极反应: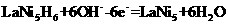
10.向X的溶液中,加人Y试剂,产生的沉淀示意图错误的是( )
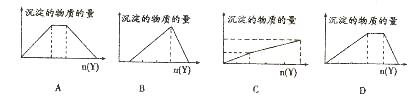
A.向NaOH和 的混合液中通人
的混合液中通人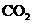
B.向含等物质的量的Hcl和 的混合液中滴加NaOH
的混合液中滴加NaOH
c.向含等物质的量的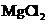 z和
z和 的混合液中滴加NaOH
的混合液中滴加NaOH
D.向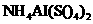 溶液中滴加NaOH
溶液中滴加NaOH
9。设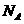 为阿伏加德罗常数,下列说法正确的是( )
为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4L正戊烷中含有的共价键数为16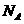
B.1L浓度为lmol·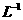 的
的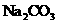 溶液中含有
溶液中含有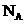 个
个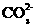
C.由 和
和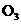 组成的混合物中共有
组成的混合物中共有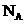 个分子,则其中的氧原子数为3
个分子,则其中的氧原子数为3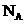
D.1molFe与足量水蒸气反应转移的电子数为3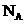
8.下列判断正确的是( )
A。凡是放热反应都是自发的,吸热反应都是非自发的
B。熵增加且放热的反应一定是自发反应
c.自发反应一定是墒增大,非自发反应一定是熵减少或不变。
D.自发反应在任何条件下都能实现
7.下列有关说法错误的是( )
A.能使品红试液褪色的气体不一定是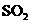
B.酸一定不是离子化合物
C.化学反应中,固态非金属可以置换出金属
I).有单质生成的化学反应一定是氧化还原反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com