
题目列表(包括答案和解析)
19.(12分) I、1840年,俄国化学家盖斯(Hess)指出:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这就是著名的“盖斯定律”。现已知在101KPa下CH4、H2、C(固)的燃烧热分别为890.83KJ ·mol-1、285.83 KJ·mol-1和393.51 KJ·mol-1,则反应C(s)+2H2(g)=CH4(g)的反应热△H= 。
Ⅱ、现有①0.2mol/L NaOH溶液和②0.2mol/L HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X-)。则:
(1)①中由水电离出的c(OH)- ②中由水电离出的c(H+)。(填“>”、“=”或“<”)
(2)上述混合液中共存在 种粒子。且:
c(HX) c(X-)。(填“>”、“=”或“<”,下同)
c(HX)+c(X-) 0.1mol/L(忽略体积变化)
请根据电荷守恒写出一个用离子浓度表示的等式: 。
(3)上述混合液显 性(填“酸”、“碱”或“中”),其原因用离子方程式表示 。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”) 25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
18.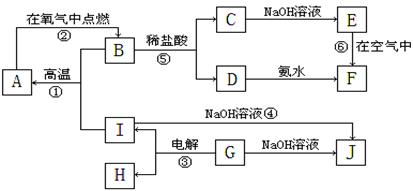 (8分)A-I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。且已知G为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,A、B、C、D、E、F六种物质中均含同一种元素。
(8分)A-I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。且已知G为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素是 。
(2)写出C、G物质的化学式:C G
(3)写出④、⑥反应的化学方程式:
反应④:
反应⑥:
(4)从能量变化的角度看,①②③反应中属于吸热反应的是_______ ____。(填序号)
17.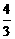 (8分)已知A、B、C、D四种短周期元素的原子序数依次增大;D的核电荷数是B的核电荷数的
倍;A分别能与B、C、D形成电子总数相等的分子X、Y、Z。
(8分)已知A、B、C、D四种短周期元素的原子序数依次增大;D的核电荷数是B的核电荷数的
倍;A分别能与B、C、D形成电子总数相等的分子X、Y、Z。
请回答下列问题:
(1)B、D两元素的名称分别是 、 。
(2)Y与C的最高正价氧化物的水化物恰好完全反应时,其生成物的水溶液呈 性
(填“酸”“碱”或“中”),其原因是(用离子方程式示) 。
(3)在(2)所得生成物的水溶液中,存在着如下关系,请用粒子浓度符号填写:
①c(H+)+ =c(OH-)+ ;
②c(NH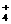 )+c(NH3·H2O)+c(NH3)=
。
)+c(NH3·H2O)+c(NH3)=
。
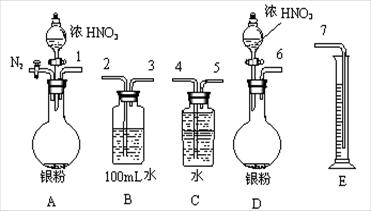
16.(14分)某课外活动小组设计了以下实验方案验证Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:


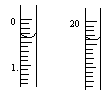

(1)测定硝酸的物质的量
 反应结束后,从下图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为
mol,则Ag与浓硝酸反应过程中生成的NO2体积为
mL。
反应结束后,从下图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为
mol,则Ag与浓硝酸反应过程中生成的NO2体积为
mL。
(2)测定NO的体积
①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验,选用的理由是 。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置
(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过
 程中
(填“有”或“没有”)NO产生,作此判断的
程中
(填“有”或“没有”)NO产生,作此判断的
依据是 。
15.(6分)I、下列实验操作、试剂保存方法和实验室事故处理,一定正确的是 (填序号)。
A.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
B.制备氢氧化铁胶体时,应向沸水中逐滴滴加1-2 mL饱和的FeC13溶液,并继
续加热到液体呈透明的红褐色为止
C.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液滴在用蒸馏水湿润过的pH试纸上,并与标准比色卡比较
D.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂瓶中
E.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用
滴管吸去多余的部分。
F.在进行反应热测定时,为保证实验的准确性,我们可以采取以下具体措施:使
用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、使用的酸碱正好
反应、进行两到三次实验,取平均值
Ⅱ、实验室常用的几种气体发生装置如图A、B、C所示:
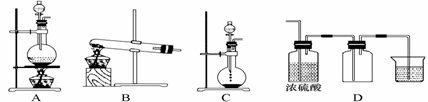
①实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是 。②气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是
(填序号,下同);
A.密度 B.颜色 C.溶解性 D.热稳定性 E.与氧气反应
③若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的 。
A.CO2 B.NO C.Cl2 D.H2
14.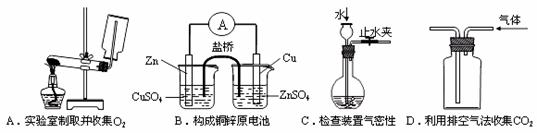 下列装置或操作能达到实验目的的是
下列装置或操作能达到实验目的的是
高三年级模块学业水平测试
化 学 2009.1
第Ⅱ卷 (非选择题,共58分)
13.X、Y元素的原子,在化学反应中都容易失去电子而形成与Ne相同的电子层结构,已知X的原子序数比Y的原子序数大,下列说法中正确的是
A.X的金属性比Y的金属性强
B.常温下,X和Y都不能从水中置换出氢
C.Y元素的最高化合价比X元素的最高化合价高
D.Y元素的最高价氢氧化物碱性比X元素最高价氢氧化物碱性强
12.下列有关沉淀溶解平衡的说法正确的是
A.KSP(AB2)小于KSP(CD),则AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的KSP增大
C.在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银
沉淀
D.在碳酸钙的沉淀溶液平衡体系中,通入CO2气体,溶解平衡不移动
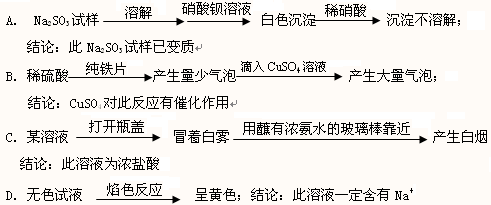
11.根据下列事实得出的结论正确的是
10.三聚氰胺被人称为“蛋白精”。它遇强酸或强碱水溶液水解,胺基逐步被羟基取代,最后生成三聚氰酸[C3N3(OH)3]。三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为: C3N3(OH)3  3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2
 7N2+8CO2+4H2O下列说法正确的是
7N2+8CO2+4H2O下列说法正确的是
A.C3N3(OH)3与HNCO为同一物质 B.HNCO是一种很强的氧化剂
C.1 molNO2在反应中转移的电子为4mol D.反应中NO2是还原剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com