
题目列表(包括答案和解析)
9.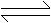 在一密闭容器内,反应a A(g)
b B(g)达到平衡后,保持温度不变,将容器 体积增加一倍,再达到平衡时,B的浓度减小为原来的60%,则 (
)
在一密闭容器内,反应a A(g)
b B(g)达到平衡后,保持温度不变,将容器 体积增加一倍,再达到平衡时,B的浓度减小为原来的60%,则 (
)
A.平衡向逆反应方向移动了 B.物质A的转化率减少了
|
8.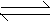 在一定体积和一定条件下有反应N2+3H2
2NH3,现分别从两条途径建 立平衡:Ⅰ.起始浓度N2mol·L-1,H2
3mol·L-1;Ⅱ.起始浓度N2 2mol·L-1,H2
6mol·L-1,下列叙述正确的是 (
)
在一定体积和一定条件下有反应N2+3H2
2NH3,现分别从两条途径建 立平衡:Ⅰ.起始浓度N2mol·L-1,H2
3mol·L-1;Ⅱ.起始浓度N2 2mol·L-1,H2
6mol·L-1,下列叙述正确的是 (
)
A.Ⅰ和Ⅱ两途径达到平衡时,体系内各成分的体积分数相同
B.达到平衡时,Ⅰ途径反应速率 等于Ⅱ途径反应速率
等于Ⅱ途径反应速率
C.达到平衡时Ⅰ途径体系内混合气体的密度为Ⅱ途径体系内混合气体的密度的
D.达到平衡时,Ⅱ途径体系内混合气体的压强是Ⅰ途径内混合气体压强的2倍
7.下列事实 不能用勒沙特列原理来解释的是 ( )
A.高压有利于合成氨的反应 B.加催化剂有利于NH3的氧化
C.往氢硫酸中加碱有利于生成S2- D.增大O2的浓度有利于SO2转化为SO3
6.向0.1mol·L-1的氨水中加入一定量的水,始终保持增大趋势的是 ( )
A.NH3·H2O浓度 B.OH-浓度 C.NH3分子数目 D.NH 数目
数目
1?有下列四种物质的溶液:①HCl ②FeCl3 ③NaOH ④Na2CO3溶液的pH值 分别为4、4、10、10,测得四种溶液中水的电离度依次为a1、a2、a3、a4,则下列 关系正确的是 ( )
A.a1=a2>a3=a4 B.a2=a4>a1=a3
C.a1=a3>a2=a4 D.a1=a2=a3=a4
2?我国在春秋战国时就懂得将白口铁进行褪火处理,这一技术要比欧洲早近两千年 。白口铁褪火处理的主要作用是 ( )
A.除S、P杂质 B.适当降低含碳量
C.渗进合金元素 D.改善表面的结构性能
3?已知钍原子(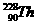 )可发生放射性变化:
)可发生放射性变化:
 其中X是生成的一种新元素,对X的判断正确的是 (
)
其中X是生成的一种新元素,对X的判断正确的是 (
)
A.X位于第六周期 B.X的最高正价为+3价
C.X的氢氧化物具有两性 D.X的单质能与冷水剧烈反应
4.将相等物质的量的SO2和H2S于常温下在定容的密闭容器内反应,待充分反应 后恢复至常温,容器内的压强是原压强的 ( )
A. B.
B. C.略小于
C.略小于 D.略大于
D.略大于
5?在100g浓度为18mol·L-1,密度为ρg/cm3的浓硫酸中加入一定量的水 稀释成9mol·L-1的硫酸,则加水的体积为 ( )
A.小于100ml B.等于100ml
C.大于100ml D.等于 ml
ml
21. (11分)对金属表面进行处理,形成一层致密的氧化物保护膜,是非常有效的一种金属防腐技术。
Ⅰ. 钢铁“发蓝”是在钢铁表面形成一层致密的Fe3O4薄膜的技术。其中一种方法是将钢铁制品浸到NaNO2和浓NaOH的混合溶液中加热到130℃。其过程可以用如下化学方程式表示:
① 3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
② 6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH
③ Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
则反应②中的氧化剂是 (填化学式),整个反应过程中,每有168 g Fe参加反应,则转移 mol电子。
Ⅱ. 铝的阳极氧化,也是一种常用的金属表面处理技术,它能使铝的表面生成一层特别致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。请填写下列空白:
(1) 配制实验用的溶液。要配制500 mL密度为1.2 g·cm-3的溶质质量分数为16%的NaOH溶液,需要称取 g NaOH固体。
(2) 把铝片浸入热的16% NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗。写出除去氧化膜有关反应的离子方程式:
。
(3) 如图,组装好仪器,接通开关K,通电约25 min。在阳极生成氧化铝,阴极产生气体。写出该过程中的电极反应式:

阳极: ;
阴极: 。
20. (10分)海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1) 从海水中可以提取单质溴,溴元素在海水中以 (选填“游离态”或“化合态”)的形式存在,溴元素在元素周期表中的位置为 。
(2) 目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是 (选填“物理
变化”或“化学变化”)。
(3) 工业上利用电解饱和食盐水可制得重要化工产品。该电解反应的离子方程式为:
。
 用惰性电极电解一定浓度的食盐水时,通过电子的物质的量与生成气体总物质的量的关系如右图所示(不考虑氯气的溶解)。若电解结束时,通过电子总物质的量为4 mol,电解后恢复至常温,溶液的体积为2 L,则溶液的pH为
,混合气体中氢气的物质的量为 。
用惰性电极电解一定浓度的食盐水时,通过电子的物质的量与生成气体总物质的量的关系如右图所示(不考虑氯气的溶解)。若电解结束时,通过电子总物质的量为4 mol,电解后恢复至常温,溶液的体积为2 L,则溶液的pH为
,混合气体中氢气的物质的量为 。
19. (12分)熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求。试回答以下问题:
(1) 在仪器:a. 分液漏斗 b. 试剂瓶 c. 集气瓶 d. 滴定管 e. 容量瓶 f. 量筒
g. 托盘天平中,标有“0”刻度的是(填序号)。 。
(2) “磨砂”是增加玻璃仪器密封性的一种处理工艺。在下列仪器中,没有用到 “磨砂”工艺处理的有(填序号) 。
a. 试管 b. 分液漏斗 c. 带滴管的试剂瓶(滴瓶) d. 集气瓶 e. 酸式滴定管
f. 碱式滴定管,
(3) 用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体。可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。请回答下列问题:
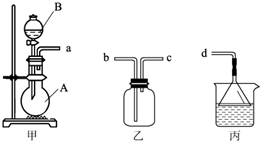
① 若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为 ,制取该气体利用了B的性质有 、 。
通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为 ;
② 若在乙中收集氨气,气体流经装置的顺序是:a→ → →d(填接口代号)。
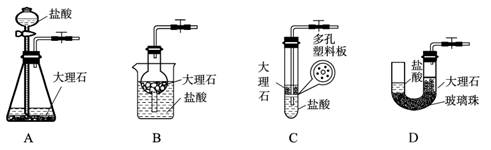
(4) 下图中的装置D是实验室制备CO2的简易装置图,用该装置制备CO2可起到随时使反应发生,也可以随时使反应停止的效果。下图中的装置A、B、C也可起到相同效果的有
(填写编号)。
18. (11分)某短周期元素A,其最高价氧化物对应水化物甲与其气态氢化物乙反应可生成盐丙。已知乙的密度是同温同压下H2密度的8.5倍。请回答:
(1) 乙的化学式为 。
(2) 甲具有不稳定性,发生分解反应的化学反应方程式为 。
实验室保存甲的方法是 。
(3) 298K时,将乙放入体积固定的密闭容器中使其发生分解反应(ΔH > 0),当反应达到平衡状态后,改变其中一个条件X,Y随X的变化符合下图中曲线的是 (选填下列各项序号字母)
 a. 当X表示温度时,Y表示乙的物质的量
a. 当X表示温度时,Y表示乙的物质的量
b. 当X表示压强时,Y表示乙的转化率
c. 当X表示反应时间时,Y表示混合气体的密度
d. 当X表示乙的物质的量时,Y表示某一生成物的物质的量
(4) 现有硫酸和甲的混合液20 mL,其中硫酸的物质的量浓度为2 mol·L-1,甲的物质的量浓度为1 mol·L-1。向该混合液中加入0.96 g铜粉,假设只生成一种无色气体,则所收集到气体的体积在标准状况下为 mL。
(5) 丙对水的电离起 作用(填“抑制”、“促进”或“不影响”),原因是(用离子方程式表示) 。
17. (9分)2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。
(9分)2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。
(1) 有人认为:该研究可以提高合成氨反应在铁催化剂表面进行的效率,从而提高原料的转化率。你是否认同他的观点 (填“是”或“否”)。理由是
。
(2) 合成氨反应: N2(g)+3H2(g)
 2NH3(g),在某温度时,K=0.4 L2·mol-2。
2NH3(g),在某温度时,K=0.4 L2·mol-2。
① 若出现下列状态,反应将向那个方向进行以达到平衡状态(在后面空白处填“向左进行”、“向右进行”或“已达平衡状态”)?
(A) c(N2)=c(H2)=1 mol·L-1,c(NH3)=0.5 mol·L-1,。
(B) c(N2) =0.3 mol·L-1,c(H2)=0.1 mol·L-1,c(NH3)=0.03 mol·L-1,。
② 若该反应升高温度再达到平衡时,K为0.2 L2·mol-2,则正反应为热反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com