
题目列表(包括答案和解析)
25.(11分)I.高炉炼铁中发生的基本反应之一是FeO(s)+CO(g)⇋Fe(s)+CO2(g) ΔH>0。其平衡常数可表达为k =c(CO2)/c(CO),已知1100℃时,k=0.263。
(1)温度升高,平衡移动后达到新的平衡,高炉内CO2和CO的体积比值 (填“增大”“减小”或“不变”),平衡常数k值 (填“增大”“减小”或“不变”)。
 (2)1100℃时测得高炉中c(CO2)=0.025mol∙L-1,c(CO)=0.1mol∙L-1,在这种情况下,该反应是否处于平衡状态
(填“是”或“否”)。此时,化学反应速率是v(正) v(逆)(填“>”“<”或“=”),原因是
(2)1100℃时测得高炉中c(CO2)=0.025mol∙L-1,c(CO)=0.1mol∙L-1,在这种情况下,该反应是否处于平衡状态
(填“是”或“否”)。此时,化学反应速率是v(正) v(逆)(填“>”“<”或“=”),原因是
II.如图所示,温度不变时,把某容器分割成A、B两部分,A容器体积固定不变,B有可移动的活塞,现在A中充入2 mol SO2和1 mol O2,在B中充入2 mol SO3和 1 mol N2,在相同条件下发生可逆反应:2 SO2(g)+O2(g)  2 SO3(g)。根据下列要求填写空白:
2 SO3(g)。根据下列要求填写空白:
(1)固定活塞位置在3处不动,达到平衡时,设A中压强为PA , B中压强为PB,则PA与PB的关系是PA _____ PB(填“<”、“=”、“>”)。
(2)若要使A与B中平衡状态相同,可移动活塞的位置应在 处。
③若活塞右移到5处,达到平衡后,B中SO3为x mol,
A中SO3为y mol , 则x和y 的关系是x y. (填“<”、“=”、“>”)。
24. (7分)已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1). 若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O 乙+丙 b.乙
乙+丙 b.乙 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金属在周期表中的位置是: 第四周期,第Ⅷ族 。
②若甲为某短周期金属元素的氯化物,则甲发生a反应的化学方程式为:
AlCl+3HOAl(OH)↓+3HCl↑ 。
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为_Al-3e-+4OH-===AlO-+2HO 。
(2)若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙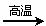 丙。则:
丙。则:
①甲的结构式为O==C==O。
②写出上述反应的化学方程式O+C2CO 。
③写出在200mL 2mol/L的NaOH溶液中通入6.72L(标准状况)的气体甲发生完全反应的总离子方程式_3CO+4OH-===2HCO-+CO2-+HO(2分,写为其它形式的均不给分)
23.(13分)为测定碳酸钙纯度(设含杂质SiO2),同学们设计了如下几个实验方案,请回答每个方案中的问题。
[方案I](1)称取碳酸钙样品 M g;(2)加入过量盐酸;(3)收集并测定生成的气体体积 V mL。
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会 (偏高、偏低、无影响)
[方案II](1)称取碳酸钙样品
M g;(2)用c mol/L 盐酸 V mL(过量)溶解样品;(3)取溶解后的溶液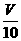 mL,用c/ mol/L NaOH溶液滴定,恰好用去V′mL。
mL,用c/ mol/L NaOH溶液滴定,恰好用去V′mL。
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外)
。
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定 (填选项编号)。
A.需要 B.不需要 C.均可
[方案III](1)称取碳酸钙样品 M g;(2)把样品高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为M/ g。
问题1:为什么要煅烧至1000℃且“直至质量不再改变”? ;
问题2:本方案中的“冷却”应如何操作 。
[方案IV](1)称取碳酸钙样品 M g;(2)加入足量c mol/L盐酸V mL使之完全溶解;(3)过滤并取滤液;(4)在滤液中加入过量c′mol/L Na2CO3溶液V′mL;(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M/ g。
问题1:此方案中不需要的数据是 (填选项编号)。
A.c、V B.c′、 V′ C. M′ D. M
问题2:为减少实验误差,必要的操作是 (填选项编号)。
A.精确测定Na2CO3溶液体积V′mL
B.精确配制浓度c′mol/L Na2CO3溶液
C.将步骤(3)所得沉淀洗涤,洗涤液也应并入(4)中
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用
问题3:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钙纯度
将 (偏高、偏低、无影响)。
综上所述,你认为4个方案中,最好的方案是 ,其它方案的缺点分别是:
方案IV:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差;
方案 ; 。
方案 ; 。
22.(12分) 学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
I 课题名称:____________________________________________________________
II实验仪器及试剂:实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、________、________、________等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
III 实验步骤:略
IV 实验数据:
|
实验 编号 |
KClO3(g) |
氧化物 |
产生气体(mL) |
耗时(s) |
||
|
化学式 |
质量(g) |
回收 |
(已折算为标况) |
|||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V 实验讨论:(1)在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、_________、________
(2)实验编号3的实验中KClO3的分解率为_________%(保留一位小数)
(3) 在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是________(填分子式),可用______________试纸检验。上述异常现象产生的原因是___________________________________。
VI 实验结论:_____________________________________________________________
21.(7分)某中学有甲、乙两个探究性学习小组,他们拟用一定质量的纯铝片与足量稀硫酸的反应测定通常状况(约20℃,101kPa)下气体摩尔体积的方法。
(1)甲组同学拟选用下列实验装置完成实验:

①该组同学必须选用的装置的连接顺序是A接( )( )接( )( )接( )(填接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因。 。
③实验结束时,该组同学应怎样测量实验中生成氢气的体积?
___________________________________________________________________________。
 (2)乙组同学仔细分析甲组同学的实验装置后,认为:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如右图所示的实验装置。
(2)乙组同学仔细分析甲组同学的实验装置后,认为:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如右图所示的实验装置。
装置中导管a的作用是 ______________________ ,
_______________________________________________________ _。
20、已知反应2A(g)+B(g) 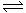 2C(g) △H<0;若甲为恒温恒压容器,乙为恒温恒容容器,初始时两容器的温度、体积相同。如果向甲容器中充入2mol A、1mol B ,向乙容器中充入a mol C,一段时间后两容器中反应均达到平衡,且两容器中A在平衡混合气中的物质的量分数相同,则下列说法可能正确的是:
2C(g) △H<0;若甲为恒温恒压容器,乙为恒温恒容容器,初始时两容器的温度、体积相同。如果向甲容器中充入2mol A、1mol B ,向乙容器中充入a mol C,一段时间后两容器中反应均达到平衡,且两容器中A在平衡混合气中的物质的量分数相同,则下列说法可能正确的是:
A、a < 2 B、a =2 ,并增大甲的压强
C、a > 2 D、a = 2 ,并降低乙的温度
19.以两块质量相同的铜板为电极,电解足量的AgNO3溶液,一段时间后,溶液质量减少了7.6g,则下列说法中正确的是:
A、电解过程共转移了0.05mol电子 B、阳极质量减少,阴极质量增加
C、两电极的质量差为14g D、两电极的质量差为7.6g
18.下列有关化学实验的操作或说法中,正确的是
A.用有少量蒸馏水的锥形瓶装待测液进行中和滴定实验,对测定结果没有影响
B.在进行硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行3次
C.苯酚中滴加少量稀溴水一定能出现三溴苯酚白色沉淀
D.检验溴乙烷中的溴元素时,将溴乙烷和氢氧化钠溶液混合加热后,需加硫酸酸化
17.我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2 + NH3 + H2O + NaCl = NaHCO3↓+ NH4Cl的反应原理制备纯碱。下面是在实验室进行模拟实验的生产流程示意图:

则下列叙述错误的是:
A.A气体是CO2,B气体是NH3
B.第Ⅲ步得到的晶体是发酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
16.下列论述中,正确的的是
A、某蓄电池的总反应式为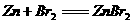 ,则充电时,阳极上发生的反应为
,则充电时,阳极上发生的反应为
2Br-- 2e- == Br2
B、用标准盐酸滴定未知浓度 溶液,滴定前仰视读数,滴定后俯视读数,会使计算结果偏低
溶液,滴定前仰视读数,滴定后俯视读数,会使计算结果偏低
C、工业硫酸生产吸收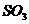 时,
时,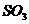 从吸收塔底部通入,水从塔顶喷下,剩余气体从塔上部放出
从吸收塔底部通入,水从塔顶喷下,剩余气体从塔上部放出
D、新型无机非金属材料虽然克服了传统无机材料的缺点,但强度比较差
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com