
题目列表(包括答案和解析)
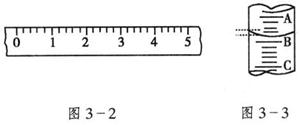
24.(10分)(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图3-2所示的游码尺上画出游码的位置(画“|”表示)。
|
砝码质量/g |
50 |
20 |
20 |
10 |
5 |
|
取用砝码情况 |
|
|
|
|
|
(2)图3-3表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中的液体的体积是__________mL。
(3)配制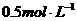 的硫酸溶液200mL所需的玻璃仪器为___________。
的硫酸溶液200mL所需的玻璃仪器为___________。
23.以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、泥三角、玻璃棒、药匙、托盘天平
实验步骤:
①准确称量一个干净、干燥的坩埚;
②在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量过的试样放入研钵中研细,再放回到坩埚中;
③将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
|
|
|
|
|
|
|
|
|
|
|
|
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
|
|
|
|
|
|
|
|
|
|
|
|
(1)完成本实验还需要的实验用品是__________________________________。
(2)指出实验步骤中存在的错误并改正:_______________________________。
(3)硫酸钠不能放置在空气中冷却的原因是____________________________。
(4)步骤⑤的目的是________________________________________________。
(5)下面的情况有可能造成测试结果偏高的是__________(填序号)
(A)试样中含有加热不挥发的杂质
(B)试样中含有加热易挥发的杂质
(C)测试前试样已有部分脱水
(D)实验前坩埚未完全干燥
(E)晶体加热脱水不完全
(F)加热时晶体溅出
22.已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
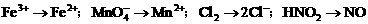
如果分别用等物质的量的这些物质氧化足量的KI,得到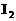 最多的是( )
最多的是( )
A. B.
B. C.
C. D.
D.
第II卷(非选择题 共56分)
21.下列叙述中,正确的是
A.含金属元素的离子一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素的化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
20.下列反应的离子方程式正确的是
A.铝片跟氢氧化钠溶液反应: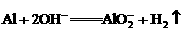
B.硫酸镁溶液跟氢氧化钡溶液反应: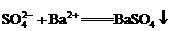
C.碳酸钙跟醋酸反应: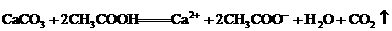
D.铜片跟稀硝酸反应: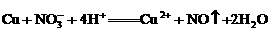
19.航天飞机用铝粉与高氯酸铵(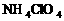 )的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:
)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:
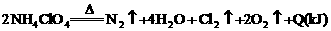 。
。
下列对此反应的叙述中错误的是
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用
18.制造太阳能电池需要高纯度的硅。工业上由粗硅制高纯度硅可能过以下反应实现:
①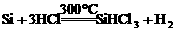 ②
②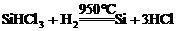
下列有关叙述错误的是
A.2个反应都是氧化还原反应 B.2个反应都是置换反应
C.反应①Si是还原剂 D.上述2个反应互为可逆反应
17.人体血红蛋白中含有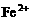 离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使
离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使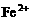 离子转变成
离子转变成 离子,生成高铁血红蛋白而丧失与
离子,生成高铁血红蛋白而丧失与 结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
A.酸性 B.碱性 C.氧化性 D.还原性
16.为检验某病人血液中的含钙量,现取10mL血液样品稀释后用草酸铵[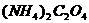 ]处理成草酸钙沉淀,将此沉淀溶于过量的稀
]处理成草酸钙沉淀,将此沉淀溶于过量的稀 中,然后用
中,然后用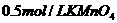 溶液(生成
溶液(生成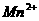 、
、 、
、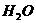 )恰好消耗1.6mL,则该病人血液中含钙量为
)恰好消耗1.6mL,则该病人血液中含钙量为
A.2.4 g/L B.8 g/L C.6 g/L D.12 g/L
15.将 的
的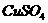 溶液与30mL 3mol/L的NaOH溶液混合,生成蓝色沉淀,假如溶液中
溶液与30mL 3mol/L的NaOH溶液混合,生成蓝色沉淀,假如溶液中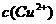 和
和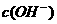 都已变得很小,可忽略,则生成沉淀的组成可表示为
都已变得很小,可忽略,则生成沉淀的组成可表示为
A.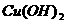 B.
B.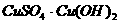
C.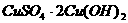 D.
D.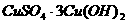
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com