
题目列表(包括答案和解析)
17.(11分)
(1)(3分)中学化学中使用前必需检查是否漏水的仪器有(任填二种):
(2)(3分)今有集气瓶、导管、带孔橡皮塞、烧杯。请组装一套收集气体装置,画出装置图。
要求:
①收集一种比空气轻,可溶于水,且有毒的气体。
②操作简便,科学性强。
③仪器只能用题目提供的。
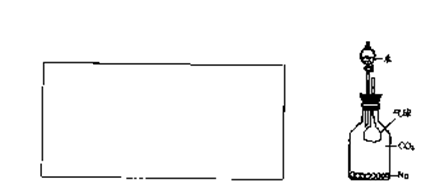
(3)(5分)按上右图进行实验,将分液漏斗中水逐滴滴人瓶内。气球最终会
A变瘪 B不变 C胀大
I.当瓴内固体生成物只有Na2CO3时,观察到气球的变化是 ;(填字母序号,下同)
II.当瓶内固体生成物只有NaHc03时,观察到气球的变化是 ;
Ⅲ.当瓶内固体生成物既有NaOH,又有Na2CO3时.观察到气球的变化是 ;
简要解释产生该现象的原因: 。
16.在一定条件下,a g三氧化硫气体在密闭容器中分解:
2SO3(g) 2SO2(g)+O2(g)△H>O
达到平衡时,容器内压强为原来的1.25倍,则平衡混合气体中各物质的量之比为:
[n(SO3):n(SO2):n(O2)]
A.任意比 B.2:2:1 C.1:l:l D.4:2:J
第Ⅱ卷(非选择题 共52分)
15.在复杂的体系中,研究化学反应的先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是 ( )
A.含有等物质的量的AlO2-,OH-,CO32-的溶液中逐滴加入盐酸:A1O2-,Al(OH)3,OH-,CO32-
B.含有等物质的量的FeBr2和FeI2溶液中缓缓通入Cl2:I-,Br-,Fe2+
C.在等物质的量的Ba(OH)2和.KOH溶液中缓缓通人CO2:KOH,Ba(OH)2,BaCO3
D.在含有等物质的量的Fe3+,Ag+,Cu+,H+的溶液中逐渐加入锌粉:
Ag+,Fe3+,Cu2+,H+,Fe2+
14.工业生产高铁酸钠可采用:Fe2O3+3Na2O2 2Na2FeO4+Na2O,下列关于该反应的说法正确的是 ( )
A.过氧化钠既是氧化剂,又是还原剂
B.高铁酸钠既是氧化产物,又是还原产物
C.当有3mol Na2O2参加反应则有12mol e-发生转移
D.在高铁酸钠中,铁的化合价为+4价,具有强氧化性,能杀菌消毒
13.在同一溶液中,含有NH4+,I-,Ba2+,Cl-等离子,则该溶液的pH和介质是 ( )
A. pH=1,硝酸溶液为介质 B.pH=3,硫酸溶液为介质
C.pH=8,次氯酸钠溶液为介质 D.pH=12,氨水为介质
12.下列关于Cl、N、S等非金属元素化合物的说法正确的是 ( )
A.漂白粉的成份是次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH处理NO2和HCl废气
D.A12(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
11.物质甲有下列现象或反应
①物质甲溶于适量稀盐酸得乙溶液
②乙溶液加入.AgNO3过滤得丙溶液
③丙溶液加不足量锌粉搅拌充分反应过滤得沉淀丁
④沉淀丁与氧气反应得物质甲
符合上述现象或反应的物质甲一定是 ( )
A.Fe2O3 B.CuO C.MgO D.ZnO
10.下列有关结论正确的是
A.T℃时,Ba(OH)2溶液中c(H+)·c(OH-)=10-12,向pH=8的该溶液加入等体积pH=4的盐酸,则混合液pH=7
B.pH相等的硫酸、盐酸、醋酸,都稀释1000倍,稀释后pH最大的是醋酸
C.0.2mol/L,的HA溶液与0.1mol/L的NaOH溶液等体积混合,混合液在常温时pH一定小于7
D.在0.1mol/L的硫酸氢铵溶液中各离子浓度关系是:c(H+)>c(SO42-)>c(NH4+)>c(OH-)
9. T℃时,反应物生成物均为气体的某反应,反应过程中浓度C的变化如图甲所示;若保持其他条件不变时,温度分别为T1,T2时,X的体积分数、温度与时间关系如图乙所示。则下列结论正确的是 ( )
T℃时,反应物生成物均为气体的某反应,反应过程中浓度C的变化如图甲所示;若保持其他条件不变时,温度分别为T1,T2时,X的体积分数、温度与时间关系如图乙所示。则下列结论正确的是 ( )
A.在t1时间内,用x表示i该反应的平均速率为0.6mol/L·min
B.在(t1+10)min时,保持其他条件不变,增大压强平衡向逆反应方向移动
C.T℃时,在相同容器内0由0.1mol/L X,0.3mol/LY,0.4mol/L Z进行反应,平衡时Z的浓度仍为0.4mol/L
D.其他条件不变,温度升高时,正逆反应速率都加快,Y的转化率也加大
8.氮化钠和氢化钠都是离子化合物,有关它们的叙述:
①原子半径:rNa>rN>rH
②离子半径:rNa+>rn3->rH+
③与水反应都是氧化一还原反应
④水溶液都显碱性
⑤与盐酸反应都只生成NaCI
⑥氢化钠晶体结构与氯化钠晶体相同,与钠离子距离最近的钠离子共有12个
其中正确的是
A.全都正确 B.①④⑥ C.①④⑤ D.②③⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com