
题目列表(包括答案和解析)
27.白色粉末A是NaHCO3与KHCO3的混合物,取甲、乙、丙3份质量不同的A样品分别与50.0mL 相同浓度的盐酸充分反应,得到气体的体积(标准状况)与A的质量关系如下表:
|
实验组别 |
甲 |
乙 |
丙 |
|
稀盐酸的体积(mL) |
50.0 |
50.0 |
50.0 |
|
A样品的质量(g) |
2.84 |
5.25 |
7.00 |
|
气体的体积(L) |
0.672 |
0.896 |
0.896 |
试计算:(1) 该盐酸的物质的量浓度。
(2) 混合物中NaHCO3的质量分数。
26.化学式为C8H1018O的化合物A具有如下性质:
①A+Na→产生气泡 ②A+RCOOH→有果香味的产物
③A能使KMnO4酸性溶液褪色(被氧化为苯甲酸)
④A的催化脱氢产物不能发生银镜反应
⑤A脱水反应的产物经聚合可制成一种塑料制品
(1)A的结构简式是 ,A的同分异构体,能与NaOH反应,苯环上的一溴代物只有两种,其结构简式是 。
(2)A与甲酸反应的方程式(并注明18O的位置) 。
(3)A脱水后的产物发生聚合反应的产物的结构简式 。
25.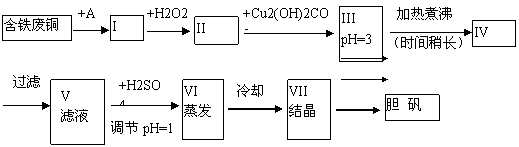 胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料。现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料。现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
pH值控制可参考下列数据
|
物 质 |
开始沉淀时的pH值 |
完全沉淀时的pH值 |
|
氢氧化铁 |
2.7 |
3.7 |
|
氢氧化亚铁 |
7.6 |
9.6 |
|
氢氧化铜 |
5.2 |
6.4 |
请根据上述流程回答下列问题:
(1)A物质可选用_____(填字母)。a.稀H2SO4 b.浓H2SO4/ D c.浓FeCl3溶液 d.浓HNO3
(2)I中加H2O2的目的_____________________________________________。
(3)II中加Cu2(OH)2CO3的目的是___________________________________________;
其优点是____________________________________________________________。
(4)III加热煮沸时发生的化学反应的离子方程式为________________________。
(5)V中加H2SO4调节pH=1是为了____________________________________________。
某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是__________。
若你是该工程师,将对所加的A物质作何改进?请提出建议___________________。
24.在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:
(填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物是
(2)现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象。
|
同学正确 |
选用试剂 |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是 若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为是否可行? (填可行或不可行)理由是:
0.09 mol·L-1,当反应到8min时,反应到达平衡,此时三氧
化硫浓度c(SO3)= a mol·L-1。
(1)0min-4min内生成O2平均速率
v(O2)= mol·L-1·min-1
(2)达到平衡时c(O2)=c(SO2),则a= mol·L-1,
在下列坐标系中作出0min-8min及之后SO2、O2、SO3
浓度随时间变化曲线.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol·L-1
的是
|
|
A |
B |
C |
D |
|
SO3 |
1mol |
3mol |
3mol |
0mol |
|
SO2 |
2mol |
1.5mol |
0mol |
6mol |
|
O2 |
2mol |
1mol |
0mol |
5mol |
23. 在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,
在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,
在一定温度下使其反应,反应至4min时,氧气的浓度为
22.已知在0.1mol·L-1的NaHSO3溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)。则:
(1)则该溶液中c(H+) c(OH-)(填“<”“>”“=”),简述理由(用离子方程式和必要的文字说明) 。
(2)现向NH4HSO3溶液中,逐滴加入少量含有酚酞的氢氧化钠溶液,可观察到的现象是 ;
写出该反应的离子方程式 。
21.(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个化学方程式,并配平。
_________+__________→__________+__________+__________+______H2O
(2)反应物中发生氧化反应的物质__________,被还原的元素是_________。
(3)反应中1 mol氧化剂_______(填“得到”或“失去”)___________ mol电子。
20. 往一体积不变的密闭容器中充入H2和I2,发生反应 H2(g)+I2(g)
往一体积不变的密闭容器中充入H2和I2,发生反应 H2(g)+I2(g)
 2HI(g),△H<0,当达到平衡后,t2时改变反应的某一条件(混合气体总物质的量不变),造成容器内压强增大,则下列说法中正确的是 ( )
2HI(g),△H<0,当达到平衡后,t2时改变反应的某一条件(混合气体总物质的量不变),造成容器内压强增大,则下列说法中正确的是 ( )
A.容器内气体的颜色变深,混合气体的密度增大
B.平衡不发生移动
C.反应物转化率增大,HI平衡浓度变小
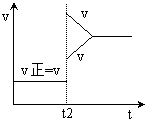
D.改变条件前后,速率图像如右图
4.上表内物质HF和H2O,由于氢键的影响,其分子特别稳定
A. 仅有一句 B.两句 C.三句 D.全部正确
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com