
题目列表(包括答案和解析)
26.(12分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe2O3。
(1)将0.050mol SO2 (g)和0.030mol O2 (g)放入容积为1IL的密闭容器中,反应: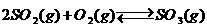 在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。计算该条件下SO2的平衡转化率(写出计算过程)。
在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。计算该条件下SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,下列措施中有利于提高s02平衡转化率的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
E.加入催化剂 F.加入过量氧气 G.加入过量SO2 H.增加热交换器
(3) SO2尾气用饱和Na2SO3溶液吸收可得到重要的化工原料,反应的化学方程式为
(4)能用于测定制取硫酸尾气中SO2含量的是 。(填字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
25.(13分)已知B、C为常见的两种金属单质,E、I为常见的两种非金属单质,A为硫酸盐。反应②为D的浓溶液与C在加热条件下的反应。P溶液和G溶液中具有相同的阳离子。请根据要求回答下列问题: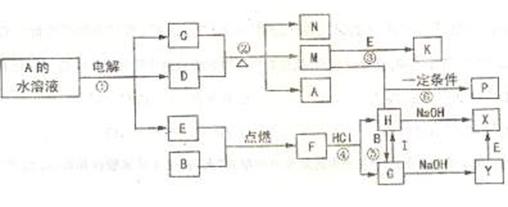
(1)写出I的化学式 ;
(2)写出反应①中阳极发生的电极反应式 ;
写出反应①的化学方程式 ;
(3)写出反应④的离子方程式 ;
写出反应⑥的离子方程式 ;
(4)每生成1 mo1气态K,反应放出98.3 kJ热量,该反应的热化学方程式为:
24.(16分)A、B、C是中学化学中常见的三种短周期元素。已知:①A元素原子最外层电子数是次外层电子数的2倍;②B元素最高正价与最低负价的代数和为2;③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;④B、C两种元素质子数之和是A元素质子数的4倍。
(1)写出A、B元素的名称:A 、B 。
(2)写出C元素在周期表中的位置: 。
(3)写出C的单质和强碱溶液反应的离子方程式 。
(4)由B、C两种元素组成的化合物x,常温下为易挥发的淡黄色液体,X分子为三角锥形分子.且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X的电子式为 ,X与水反应的化学方程式是
。
(5)A、B两种元素可形成一种硬度比金刚石还大的化合物Y。在化合物Y中,A、B原子间以单键相结合,且每个原子的最外层均达到8个电子的稳定结构。则Y的化学式为
。Y晶体的熔点比金刚石熔点 (填“高”或“低”)。
23.(10分)白磷(P4)是一种常见的晶体,可用于制备较纯的磷酸。
(1)白磷是 晶体(填“离子”、“分子”、“原子”或“金属”),31 g白磷与足量的氧气完全燃烧释放出745.5 kJ的热量,请写出白磷燃烧的热化学方程式:
(2)已知白磷和氯酸溶液可发生如下反应;
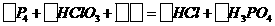
配平并完成上述反应方程式,标出电子转移的方向和数目,该反应的氧化剂是 。
(3)白磷有毒,在实验室可采用CuSO4溶液进行处理,其反应为:
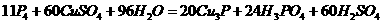
该反应的氧化产物是 ,若有11 mol P4参加反应,则有 mol电子转移。
22.在一定条件下化学反应: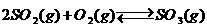 ;△H= 一197 kJ·mol-1。现有容积固定且相同的甲、乙、丙三个容器。在上述条件下分别充入的气体和该反应放出的热量(Q)如下表所列:
;△H= 一197 kJ·mol-1。现有容积固定且相同的甲、乙、丙三个容器。在上述条件下分别充入的气体和该反应放出的热量(Q)如下表所列:
|
容器 |
SO2(mol) |
O2(mol) |
He(mol) |
Q(kJ) |
|
甲 |
2 |
1 |
0 |
Ql |
|
乙 |
1 |
0.5 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
l |
Q3 |
根据以上数据,下列比较不正确的是
A.Ql <197 B.Q2=Q3 C.Ql =2Q2 D.Ql >2Q2
第Ⅱ卷(非选择题共79分)
21.有关键能数据如表:
|
化学键 |
Si-O |
O=O |
Si-Si |
|
键能/kJ·mol-1 |
X |
498.8 |
176 |
晶体硅在氧气中燃烧的热化学方程式: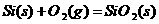 ;△H=-989.2 kJ·mol-1则X的值为
;△H=-989.2 kJ·mol-1则X的值为
A.314.4 B.460 C.548 D.832
20.据悉,2008年北京奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾,撞击时发生反应的化学方程式为:5KClO3+6P=3P2O5+5KCl,则下列有关叙述不正确的是
A.上述反应中氧化剂和还原剂的物质的量之比为5:6
B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
C.上述反应中消耗3 mol P时,转移电子的物质的量为15 mol
D.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
19.已知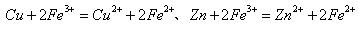 ,现把等物质的量的CuSO4、FeCl3和Zn置于水中,充分反应后,反应器中所得的混合物中除SO42-和Cl-外,还有
,现把等物质的量的CuSO4、FeCl3和Zn置于水中,充分反应后,反应器中所得的混合物中除SO42-和Cl-外,还有
A.只含有Zn2+、Cu、Fe2+ B.只含有Zn2+、Cu2+、Fe2+
C.Zn2+、Cu2+、Fe2+、Fe D.Zn2+、Cu2+、Fe2+、Cu
18.某溶液中含有NaCl和H2SO4两种溶质,它们的物质的量之比为3:1。用石墨作电极电解该混合溶液时,根据电极产物,可明显分为三个阶段。下列叙述不正确的是
A.阴极自始至终只析出H2
B.阳极先析出C12,后析出O2
C.电解的最后阶段为电解水
D.溶液pH值不断增大,最后为7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com