
题目列表(包括答案和解析)
17.(共7分)甲 、乙、丙、丁、戊均为中学化学常见的单质或化合物,且均含有同一种元素R,在一定条件下其转化关系如右图所示。
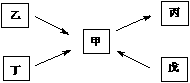
(1)若R为一种非金属元素,且上述五种物质含有不同的官能团,丁为带水果香味的液体,乙和丁均能在碱性条件下生成甲,戊是一种无色气体,相同条件下相对H2的密度为14,则由甲在一定条件下生成戊的化学方程式为 ,欲检验乙中官能团,所选用的试剂为(填序号) 。
① NaOH溶液 ② Br2的CCl4溶液 ③银氨溶液 ④ AgNO3溶液 ⑤ 稀HNO3
(2)若R为另一种非金属元素,甲与丙为常见大气污染物,且甲与丙的相对分子质量相差16。丁为空气的主要成分之一。则丁的电子式为 ,乙的空间构型为 ;戊的稀溶液能跟过量铁粉反应,其离子方程式为 。
(3)若R为一种金属元素,乙由两种元素组成,甲溶液的pH小于7,单质丁在一定条件下可生成戊。甲与戊两种溶液混合生成沉淀丙的离子方程式为 ,除去镁粉中混有少量的丁,涉及的离子方程式为 。
16.(共6分)请根据工业制硫酸的有关知识回答下列问题
(1)黄铁矿在沸腾炉中反应的化学方程式为 。
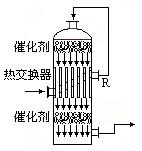 (2)在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。按此密闭体系中气体的流向, 则在R处流出的气体中除N2外的主要组成为(填序号) 。
(2)在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。按此密闭体系中气体的流向, 则在R处流出的气体中除N2外的主要组成为(填序号) 。
a.SO2 b.SO2、SO3
c.SO2、O2 d.SO3、O2 、SO2
(3)接触法制硫酸过程中:2SO2(g) + O2(g)
 2SO3(g)
2SO3(g)
根据下表中的数据判断下列图像正确的 。
  SO2 转化率 压强 SO2 转化率 压强温度 |
P1 ( MPa) |
P2( MPa) |
|
400℃ |
99.6 |
99.7 |
|
500℃ |
96.9 |
97.8 |
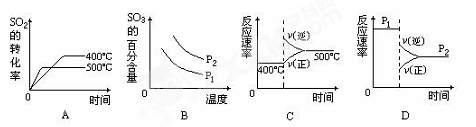
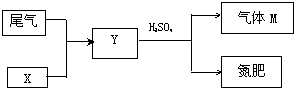
(4)下图是工业制硫酸的尾气的综合利用,气体M回收后可进入接触室循环生产,请根据图示判断X是(填名称) ,写出Y与硫酸反应生成M的化学方程式 。
15.9.7 g Cu和Zn的合金与足量的稀HNO3反应,还原产物只有NO气体,其体积在标准状况下为2.24 L。将溶液稀释为1 L,测得溶液的pH=1,此时溶液中NO3-的浓度为
A.0.3 mol/L B.0.4 mol/L C.0.5 mol/L D.0.6 mol/L
海淀区高三年级第一学期期中练习
化 学 2009.1
学校 班级 姓名
请将第Ⅰ卷中各小题答案前的字母,填写到下表中相应的位置上。
第Ⅱ卷(非选择题 共55分)
14.某温度时,用惰性电极电解硝酸钠的不饱和溶液。若两极收集到气体总体积为22.4a L时,剩余溶液恢复至原温,析出溶质m g;若两极收集到气体总体积为33.6a L时,剩余溶液恢复至原温,析出溶质n g。则硝酸钠在该温度时的溶解度是(气体体积均已折合为标准状况下的体积)
A.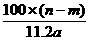 g B.
g B.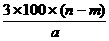 g
g
C.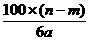 g D.
g D. g
g
13.下列说法不正确的是
A.金属元素的最外层电子数不一定小于4
B.ⅠA族元素形成的单质的熔点随原子序数的递增而降低
C.同主族第三、第四周期的元素原子序数之差不一定等于18
D.单质磷的化学性质比氮气活泼,容易与非金属等物质反应
12.对于反应O3+ I-+ H+ - I2 + O2+H2O(未配平),下列说法正确的是
A.O2和H2O是还原产物
B.该反应能说明O2氧化性大于I2
C.氧化产物与还原产物的物质的量之比是1∶1
D.配平后的化学方程式为:2O3 + 2I-+ 4H+ = I2 + 2O2 + 2H2O
11.已知热化学方程式C2H2 (g) + 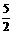 O2
(g)= 2CO2 (g) + H2O (g);ΔH=
-1256 kJ/mol,下列说法正确的是
O2
(g)= 2CO2 (g) + H2O (g);ΔH=
-1256 kJ/mol,下列说法正确的是
A.乙炔的燃烧热为1256 kJ /mol
B.若转移10 mol电子,则消耗2.5 mol O2
C.若生成2 mol 液态水,则ΔH = -2512 kJ/mol
D.若形成4 mol碳氧共用电子对,则放出的热量为2512 kJ
10.只用试管和胶头滴管就可以鉴别的下列各组溶液是
①AlCl3溶液和NaOH溶液 ②Ca(HCO3)2溶液和NaOH溶液 ③NaAlO2溶液和盐酸
④Al2(SO4)3溶液和氨水 ⑤AgNO3溶液和氨水
A.①③⑤ B.①②③ C.②③④ D.③④⑤
9.实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象。图中所示的实验,点滴板上描述的现象正确的是
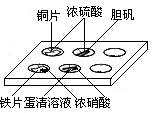 ①装有铜片的孔穴中溶液呈蓝色
①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变浅
③装有铁片的孔穴中溶液呈浅绿色
④装有铁片的孔穴中溶液呈浅黄色
⑤装有蛋清溶液的孔穴中呈浅黄色
A.①④ B.②③ C.①⑤ D.②⑤
8.下列离子方程式书写正确的是
A.碘化亚铁溶液通入少量氯气:2Fe2+ + 2I- +2Cl2 = 2Fe3+ + 4Cl- +I2
B.苯酚钠溶液通入少量二氧化碳:C6H5O-+CO2+H2O=C6H5OH+CO32-
C.碳酸氢钠溶液加入少量石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D.硫酸氢铵溶液加入足量氢氧化钡溶液:2NH4++Ba2++SO42-+2OH-=BaSO4↓+2NH3·H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com