
题目列表(包括答案和解析)
20.某温度时,BaSO4在水中的沉淀溶解平衡曲
线如图所示。下列说法正确的是
提示:BaSO4(s) Ba2+(aq)+SO42-(aq)的
Ba2+(aq)+SO42-(aq)的
平衡常数 Ksp=c(Ba2+)·c(SO42-),称为溶度积
常数。 ( )
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
19.1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:
X(g)+a Y(g)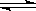 b Z(g) 反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
b Z(g) 反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
( )
A.a=1,b=1 B.a=2,b=1
 C.a=2,b=2 D.a=3,b=4
C.a=2,b=2 D.a=3,b=4
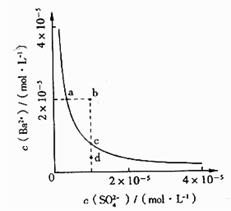
18.有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯( )中而形成的,电池总反应方程式为:8Li + 3SOCl2
)中而形成的,电池总反应方程式为:8Li + 3SOCl2
6LiCl + Li2SO3 + 2S,下列叙述中正确的是 ( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1
17. CuI是一种不溶于水的白色固体,它可以由反应:
CuI是一种不溶于水的白色固体,它可以由反应:
2Cu2++4I―==2CuI↓+I2而得到。如图所示装置中,
a、b都是惰性电极,通电一段时间后,在KI-
淀粉溶液中阳极周围变蓝色,则下列说法正确的
是 ( )
A.若a极变红,则在Pt电极上:2I― -2e-==I2
碘遇淀粉变蓝
B.若b极变红,在Pt电极上: 4OH― –4e-==2H2O+O2
O2将I-氧化为I2,碘遇淀粉变蓝
C.若a极变红,在Cu电极上:开始Cu+ I- -e-==CuI,
一段时间后2 I--2e-==I2 碘遇淀粉变蓝
D.若b极变红,在Cu极上:Cu-2e-==Cu2+ Cu2+ 显蓝色
16.下列各组离子在碱性条件下能大量共存,在强酸性条件下能发生氧化还原反应的是( )
A.Ca2+、AlO2-、SO42-、Cl- B.K+、ClO-、Cl-、NO3-
C.Na+、K+、NO3-、SO42- D. NH4+、Na+、F-、CO32-
15.下列反应的离子方程式正确的是 ( )
A.次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2 = CaCO3↓+2HClO
B.硫酸亚铁溶液中加入过氧化氢溶液:Fe2+ +2H2O2 +4H+ = Fe3++ 4H2O
C.用氨水吸收少量二氧化硫:NH3·H2O +SO2 = NH4++ HSO3-
D.硝酸铁溶液中加过量氨水:Fe3+ +3NH3·H2O = Fe(OH)3↓+3NH4+
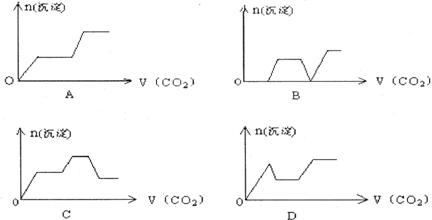
14.将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为 ( )
13.NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.标准状况下,22.4LCHCl3中含有氯原子数目为3NA
B.7gCnH2n中含有的氢原子数目为NA
C.18 g D2O中含有的质子数目为10 NA
D.1 L0.5mol/LNa2CO3 溶液中含有的CO32-数目为0.5 NA
12.下列说法正确的是 ( ) A.常温下醋酸分子不可能存在于pH>7的碱性溶液中
B.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(Cl-) >c(NH4 +)
C.0.1mol·L-的氯化铵溶液与0.05mol·L-的氢氧化钠溶液等体积混合溶液中离子浓度
c(Cl-)>c(NH4+)>c(Na+)>c(OH-)
D.0.1mol·L-1硫化钠溶液中离子浓度关系c(Na+)=c(S2-)+c(HS-)+c(H2S)
11.标准状况下,将aLH2和Cl2的混合气体点燃,充分反应后,将混合气体通入含bmolNaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl- ClO- ClO3-,且三者物质的量之比为8:1:1,则原混合气体中H2的物质的量为 ( )
A. a/2mol B.(a/22.4-b)mol
C.(a/22.4-b/2)mol D.b/2mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com