
题目列表(包括答案和解析)
22.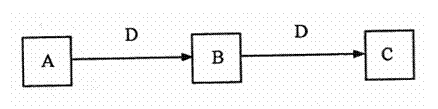 (8分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分产物已略去):
(8分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分产物已略去):
请按要求回答下列问题:
(1)若D为强氧化性单质,则A可能是 (填序号);
a.S b.N2 c.Na d.Mg e.Al
(2)若D为用途极广的某金属单质,向C的溶液中滴加AgNO3溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式为 ;C溶液在贮存时应加入少量的D,理由是 ;
(3)若D为强电解质,A和C在溶液中反应生成的B是白色絮状沉淀,则B的化学式为 ,A和C反应的离子方程式是 。
21.(10分)现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A、D同主族,C、E同主族,D、E、F同周期。A、B的原子最外层电子数之和与C原子的最外层电子数相等。A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态。A能分别与E、F形成电子总数相等的气体分子。
请问答下列问题:
(1)A~F六种元素原子,原子半径最大的是 (填对应的元素符号,下同);
(2)A与B两种元素组成一种阳离子,该离子的检验方法为 ;
(3)C、D两种元素组成的化合物中,既含有离子键,又含有非极性共价键,该化合物的电子式为 ;
(4)E、F两种元素中非金属性较强的是 ,能够证明这一结论的化学事实是 。
20.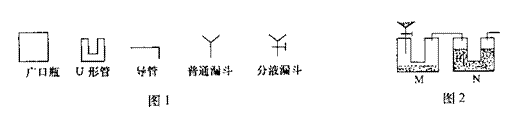 (11分)Na2CO3是一种重要的化工原料,某学生甲拟在实验室中测量Na2CO3的纯度。他利用图1中给出的仪器设计了图2所示的装置(本题装置图中所用塞子均未画出;杂质不参与反应),其中M容器中盛有Na2CO3样品10.0g,分液漏斗盛有稀硫酸,N容器内为碱石灰固体。他利用碱石灰的增重来求算Na2CO3的纯度。
(11分)Na2CO3是一种重要的化工原料,某学生甲拟在实验室中测量Na2CO3的纯度。他利用图1中给出的仪器设计了图2所示的装置(本题装置图中所用塞子均未画出;杂质不参与反应),其中M容器中盛有Na2CO3样品10.0g,分液漏斗盛有稀硫酸,N容器内为碱石灰固体。他利用碱石灰的增重来求算Na2CO3的纯度。
(1)学生乙认为,按学生甲设计的装置进行实验,存在明显缺陷,其中导致测定结果偏低的是 ;
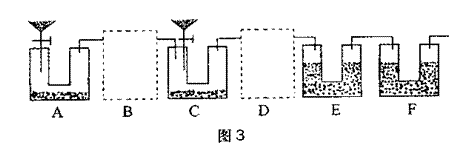 (2)学生乙对学生甲设计的实验装置进行了完善(如图3)。实验室中可供选择的药品:Zn、浓H2SO4、稀H2SO4、NaOH溶液、碱石灰、CaCO3、水。请回答下列问题:
(2)学生乙对学生甲设计的实验装置进行了完善(如图3)。实验室中可供选择的药品:Zn、浓H2SO4、稀H2SO4、NaOH溶液、碱石灰、CaCO3、水。请回答下列问题:
①B、D虚框内是否需要添加装置,若需要,在相应虚框内画出装置图(并注明药品);若不需要,在相应虚框内打“×”;
②A装置中分液漏斗内液体为 ,U型管内药品为 ;
装置F的作用为 ;
③如果B、D内部不设计任何装置而直接连通ACE,则实验结果将 (填“偏高”、“偏低”或“无影响”);
④如果实验后E装置质量增重3.96g,则该Na2CO3试样的纯度为 。
18.
 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。下列说法中不正确的是 ( )
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。下列说法中不正确的是 ( )
A.在30min时降低温度,40min时升高温度
B.8min前A的平均反应速率为0.08 mol·L-1·min-1
C.反应方程式中的x=1,正反应为放热反应
D.20min~40min间该反应的平衡常数均为4
第Ⅱ卷(非选择题 共54分)
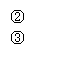


 Fe2+ Fe3+ FeO42-
Fe2+ Fe3+ FeO42-
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液实现上述①的转化,要求产物纯净。可选用的试剂是 (选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+===Cu2++5Fe2++2S(CuFeS2中S为-2价)。
则下列说法正确的是 (选填序号);
a.从物质的组成来看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1 mol e-时,有46 g CuFeS2参加反应
(3)高铁酸钾是一种新型、高效的绿色净水剂,其净水原理是 。
17.a、b、c、d、e分别为MgCl2、KHSO4、KOH、NaHCO3、AlCl3五种溶液中的一种,其中a能与其余四种溶液反应,且与c、e反应时有明显的现象;b与d反应只产生气泡;e只能与a反应。下列推理不正确的是 ( )
A.a一定为KOH B.b一定为KHSO4
C.c一定为AlCl3 D.e一定为MgCl2
16.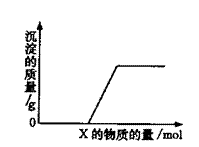 将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如下图所示,符合图中情况的一组物质是 ( )
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如下图所示,符合图中情况的一组物质是 ( )
|
|
X |
Y |
|
A |
Ba(HCO3)2溶液 |
NaOH溶液 |
|
B |
KOH溶液 |
Mg(HSO4)2溶液 |
|
C |
Na2CO3溶液 |
CaCl2溶液 |
|
D |
CO2气体 |
石灰水 |
15.今有室温下四种溶液,有关叙述不正确的是 ( )
|
|
① |
② |
③ |
④ |
|
pH |
11 |
11 |
3 |
3 |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.VaL④与VbL②溶液混合,若混合后溶液pH=4,则Va∶Vb=11∶9
14.短周期元素A、B、C原子序数依次递增,它们的原子最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数。下列有关叙述正确的是 ( )
A.原子半径A<B<C
B.A元素氢化物的稳定性小于C的氢化物
C.B与C的单质都可与烧碱溶液反应
D.B单质在一定条件下能与A的氧化物剧烈反应
13.在100mL FeI2溶液中缓缓通入标准状况下的氯气3.36L,
反应完全后,溶液中有一半的Fe2+被氧化生成Fe3+。
则原来FeI2溶液的物质的量浓度为 ( )
A.1 mol·L-1 B.1.2 mol·L-1 C.1.5 mol·L-1 D.6 mol·L-1
12.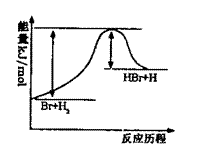
 参照反应Br+H2 HBr+H在整个反应历程中能量变化的示意图判断,下列叙述中正确的是 ( )
参照反应Br+H2 HBr+H在整个反应历程中能量变化的示意图判断,下列叙述中正确的是 ( )
A.该反应为吸热反应
B.加入催化剂,该化学反应的反应热改变
C?该反应为放热反应
D.加入催化剂可增大正反应速率,降低逆反应速率
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com