
题目列表(包括答案和解析)
4、实验室中欲制氢气,最好的方法是
A.纯锌与稀硫酸反应 B.纯锌与浓硫酸反应
C.纯锌与稀盐酸反应 D.粗锌(含铅、铜杂质)与稀硫酸反应
3、下列变化中属于原电池的是
A.在空气中金属铝表面迅速氧化形成保护层
B.白铁(镀锌)表面有划损时,也能阻止铁被氧化
C.红热的铁丝与水接触表面形成蓝黑色保护层
D.铁与稀硫酸反应时,加入少量硫酸铜溶液时,可使反应加速
2.废电池处理不当不仅造成浪费,还会对环境造成严重污染,对人体健康也存在极大的危害。有同学想变废为宝,他的以下想法你认为不正确的是
A.把锌皮取下洗净用于实验室制取氢气 B.碳棒取下洗净用作电极
C.把铜帽取下洗净回收利用
D.电池内部填有氯化铵等化学物质,将废电池中的黑色糊状物作化肥用
1.随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品 D.回收其中石墨电极
4、验证;两电极反应式相加所得式子和原化学方程式相同,则书写正确。
典例剖析
[例1]把a、b、c、d四块金属浸入稀硫酸中,用导线两两相连组成原电池,若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时, c极上产生大量气泡;b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序为
A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a
解析:根据原电池原理:作为负极的金属活动性比正极的金属活动性强,电子流动方向是由负极流向正极,电流方向与电子流动方向相反,因此依次作出判断:活泼性a>b;c>d;a>c;d>b。答案为B。
[例2]在用Zn片、Cu片和稀硫酸组成的原电池装置中,经过一段时间工作后,下列说法正确的是
A.锌片是正极,铜片上有气泡产生 B.电流方向是从锌片流向铜片
C.溶液中硫酸的物质的量浓度减小 D.电解质溶液的pH保持不变
解析:活泼金属锌为负极,电流方向由正极到负极,与电子流动方向相反,随着H+消耗,pH逐渐增大。答案为C
[例3]美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
??(1)a是__极,b是__极.电极反应式分别是_____________、______________。
??(2)飞船上宇航员的生活用水由燃料电池提供.已知这种电池发1度电能生成350g水,试计算能量的转化率。(已知: 2H2(g)+O2(g)=2H2O(1);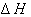 =-572kJ/mol)
=-572kJ/mol)

??(3)这种电池的输出电压为1.2V,用它使标有“1.2V 1.5W”的小灯泡发光1h,需要消耗标准状态下的 H2多少升?
???解析:(1)a中的 H2失去电子被氧化,是负极;b中的 O2得到电子被还原,是正极.两电极的反应分别是:

??(2)由方程式: 2H2(g)+O2(g)=2H2O(1);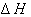 =-572kJ/mol可知,发生350g液态水放出的热量为:
=-572kJ/mol可知,发生350g液态水放出的热量为:
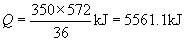 kJ.
kJ.
这过程中产生的电能是1度,即 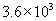 kJ,因此能量转化率为:
kJ,因此能量转化率为: 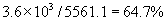 .
.
(3)1.5W灯泡连续发光1h,消耗的电能: 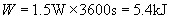 ,
,
??产生这些电能需要消耗化学能: 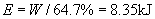 .
.
这过程中消耗标准状态下的氢气的体积: 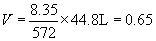 L.
L.
[例4]1991年我国首创以铝-空气-海水电池作为能源的新型海水标志灯,以海水为电解质,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水中数分钟,就会发出耀眼的白光,其总反应方程式为:4Al + 3O2 + 6H2O = 4Al(OH)3,则该电源的负极材料为 ,正极材料为 ,负极反应
正极反应 。
解析:Al 、O2(空气)之间的氧化还原反应为:4Al + 3O2 = Al2O3.将该反应与原电池原理、铝的导电性等知识进行综合分析可知,铝既是负极产物,又是反应材料,O2是正极反应物,正极材料应该选择还原性比铝弱的导电性强的材料,如石墨等
铝、O2的氧化反应、还原反应分别为:Al – 3e- = Al3+,O2 + 2H2O + 4e- = 4OH-
答案:铝 石墨 负极反应:Al – 3e- = Al3+,O2 + 2H2O + 4e- = 4OH-
[例5](2005年江苏高考化学题)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2
+ 2Fe(OH)3
+ 4KOH,下列叙述不正确的是
3Zn(OH)2
+ 2Fe(OH)3
+ 4KOH,下列叙述不正确的是
A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 -3e-+ 5OH-=FeO42-+ 4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性增强
解析:高铁电池放电(原电池)时的负极反应为3Zn+6OH--6e-=3Zn(OH)2,正极反应为2FeO42-+8H2O+6e-==2Fe(OH)3+10OH-;充电(电解池)时的阴极反应为3Zn(OH)2+6e-==3Zn+6OH-,阳极反应为2Fe(OH)3+10OH--6e-==2FeO42-+8H2O。从而不难分析出答案为C。
知能训练
3、氧化反应在负极发生,还原反应在正极发生,注意介质可能参与反应;
2、根据总反应方程式从电子得失(或元素化合价升降)的角度,将总反应分成氧化反应和还原反应;
原电池反应所依托的化学反应原理是氧化还原反应,书写电极反应的方法归纳如下:
1、写出总化学反应方程式(即氧化还原反应方程式);
4、根据原电池两极发生的变化来判断。原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
注意:如Mg、Al与NaOH溶液形成原电池;Fe、Cu与浓硝酸形成原电池。都是相对不活泼金属作负极。
2、根据电流方向或电子流动方向判断。电流是由正极流向负极,电子流动方向是由负极流向正极。 3、根据原电池里电解质溶液内离子的定向流动方向判断。在原电池的电解质溶液内,阳离子移向的极是正极,阴离子流向的极为负极。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com