
题目列表(包括答案和解析)
16.常温时,下列两种溶液等体积混合后,混合液中微粒的物质的量浓度关系正确的是
A.0.1mol·L-1的NaOH溶液与0.1mol·L-1的H2SO3溶液(混合后呈酸性):c(H2SO3)>c(SO32-)
B.0.1mol·L-1的NaOH溶液与0.1mol·L-1的醋酸溶液:c(Na+)<c(CH3COO-)
C.pH=3的盐酸和pH=11的氨水:c(OH-)>c(H+)
D.0.1mol·L-1的NH4Cl溶液和0.1mol·L-1的氨水(混合后呈碱性):c(NH4+)<c(Cl-)
15.某无色溶液,由Na+、Ba2+、Al3+、AlO2-、Fe3+、CO32-、SO42-中的若干种组成。取适量该溶液进行如下实验:① 加入过量盐酸,有气体生成;② 在①所得的溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;③ 在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。原溶液中一定存在的离子是
A.Al3+、Fe3+、SO42 B.Na+、AlO2-、CO32-
C.Na+、AlO2-、SO42-、CO32 D.Na+、Ba2+、AlO2-
14.某化合物的结构(键线式)及球棍模型如下:
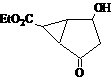
下列关于该有机物的叙述正确的是
A.该有机物不同化学环境的氢原子有8种 B.该有机物属于芳香族化合物
C.键线式中的Et代表的基团为-CH3 D.该有机物不能发生消去反应
13.下列物质不能通过化合反应制取的是
A.FeCl2 B.SO3 C.Fe(OH)3 D. H2SiO3
12.根据下列事实所得出的相应结论正确的是
|
|
实 验 事 实 |
结 论 |
|
A |
常温下1mol·L-1醋酸的酸性比0.1 mol·L-1醋酸强 |
弱酸的电离度随浓度的增大而增大 |
|
B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
|
C |
NaBr溶液中通入Cl2时,溶液变橙黄色 |
非金属性:Cl>Br |
|
D |
盐酸酸性比氢硫酸(H2S的水溶液)强 |
非金属性:Cl>S |
11.
 2008年9月13日中央电视台报导了某集团在牛奶中添加三聚氰胺使全国多名婴幼儿患上肾结石的“某某奶粉重大安全事故”,国务院立即启动国家重大食品安全事故I级响应。三聚氰胺是一种有机化工原料,结构如下图所示,工业上用尿素制取三聚氰胺,反应方程式:6CO(NH2)2 C3N6H6
+ 6NH3 + 3CO2
2008年9月13日中央电视台报导了某集团在牛奶中添加三聚氰胺使全国多名婴幼儿患上肾结石的“某某奶粉重大安全事故”,国务院立即启动国家重大食品安全事故I级响应。三聚氰胺是一种有机化工原料,结构如下图所示,工业上用尿素制取三聚氰胺,反应方程式:6CO(NH2)2 C3N6H6
+ 6NH3 + 3CO2
下列说法中正确的是
A.三聚氰胺是一种氨基酸
B.三聚氰胺与盐酸不反应
C.某某婴幼儿奶粉中加入三聚氰胺,可以提高含氮量,从而使蛋白质含量提高
D.从原子利用率角度考虑,该反应不符合绿色化学理念
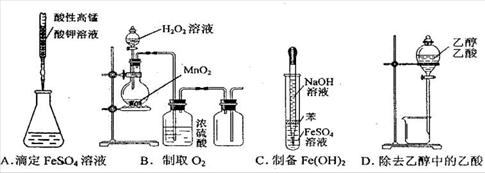
10.下列操作或仪器的选用正确的是
9.液体铝钠合金(单质钠和单质铝熔合而成) 可用作核反应堆内载热介质,有关说法不正确的是
A.原子半径:Na>Al
B.铝钠合金若投入一定量的水中可充分反应无金属剩余,则n(Al) ≤ n(Na)
C.m g不同组成的铝钠合金投入足量盐酸中,若放出H2越多,则铝的质量分数越小
D.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出
8.设NA为阿伏加德罗常数的值,下列说法中一定正确的是
A.在标准状况下,V升 SO3含氧原子个数是3VNA/22.4
B.0.1molCnH2n+2中含有的C-C键数为0.1×n×NA
C.常温常压下,22g氧气和26g臭氧混合气体所含氧原子总数为3NA
D.1 mol Cl2发生反应时,转移的电子数一定是2 NA
7.使用酸碱中和滴定的方法,用0.01mol·L-1盐酸滴定锥形瓶中未知浓度的NaOH溶液,下列操作能够使测定结果偏高的是
①用移液管量取浓盐酸配制0.01 mol·L-1稀盐酸时,移液管用蒸馏水洗净后未经干燥直接量取浓盐酸;②配制稀盐酸定容时,俯视容量瓶刻度线;③滴定结束时,读数后发现滴定管下端尖嘴处悬挂有一滴液滴;④滴定过程中用少量蒸馏水将锥形瓶内壁粘附的盐酸冲下
A.仅①③ B.仅②④ C.仅②③④ D.①②③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com