
题目列表(包括答案和解析)
1.2008年夏季奥运会将在北京举行,届时要突出“绿色奥运、科技奥运、人文奥运”理念。绿色奥运是指( )
A.加大反恐力度,并讲求各国运动员的营养搭配,使他们全身心投入比赛。
B.严禁使用兴奋剂,使运动员公平竞争
C.把环境保护作为奥运设施规划和建设的首要条件
D.奥运场馆建设均使用天然材料,不使用合成材料
25.(10分)取等物质的量浓度的NaOH溶液两份甲和乙各100 mL,分别向甲、乙中通入
不等量的 CO2,再继续向两溶液中逐滴加入2mol·L-1的盐酸,标准状况下产生的CO2
气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:
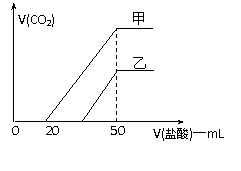 (1)NaOH溶液的物质的量浓度为 ▲ 。
(1)NaOH溶液的物质的量浓度为 ▲ 。
(2)在甲NaOH溶液中通入CO2后,所得溶液中的溶质
成分是 ▲ 。(填化学式)
其物质的量之比为 ▲ 。
(3)曲线乙可知,乙NaOH溶液中通入CO2后,所得
溶液加盐酸后产生CO2气体体积(标准状况)
的最大值为 ▲ mL。
产生CO2气体时的离子方程式是 ▲ 。
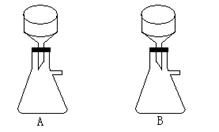
24.(16分)硫酸铜是一种应用极其广泛的化工原料。某同学利用车床加工的废铜屑制备硫酸铜。实验前先将废铜屑置于Na2CO3溶液中煮沸5分钟,然后汲去Na2CO3溶液,再用蒸馏水洗涤3次。由于铜不与稀硫酸直接反应,实验中将浓硝酸分次加入到铜粉与稀硫酸中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示,烧杯中盛有NaOH溶液)。

(1)实验前先将废铜屑于Na2CO3溶液中煮沸5分钟的目的是 ▲ 。
(2)圆底烧瓶中发生的离子反应方程式为 ▲ 。
(3)图2是图1的改进装置,改进后的好处是 ▲ 。
(4)为符合绿色化学的要求,某研究性学习小组改用空气氧化法:
方案1:将铜屑在空气中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜屑与稀硫酸的混合物中,发现在常温下几乎不反应。但是向反应液中加少量FeSO4或Fe2(SO4)3溶液,反应很快进行。反应完全后,继续通入空气并加物质甲调节pH值到3-4,产生Fe(OH)3沉淀。过滤,滤渣作催化剂循环使用。滤液经过蒸发浓缩、结晶、减压抽滤后得到蓝色晶体,再用少量95%的酒精洗涤晶体后晾干,得CuSO4·5H2O10.6g。己知Fe(OH)3和Cu(OH)2完全沉淀时的pH值分别为3.7、6.4请回答下列问题:
①方案2中甲物质可能是 ▲ (填字母)。A.CaO B.CuO C.Na2CO3 D.NaOH
②FeSO4或Fe2(SO4)3溶液的作用是 ▲ ,不能选用FeCl3、FeCl2代替
FeSO4、Fe2(SO4)3溶液的原因是 ▲ 。
③晶体采用95%的酒精淋洗的优点是 ▲ 。
④下图是抽滤装置的一部分,其中正确的是 ▲ 。(填A或B)
⑤采用方案1以64g铜为原料与一定质量的 ▲ (填质量分数)的硫酸反应在理论
上不需要蒸发水刚好生成CuSO4·5H2O晶体 。(结果保留3位有效数字)
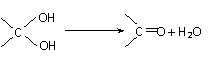
23.(14分)已知:一个碳原子上连有两个羟基时不稳定,易发生下列转化:
某烃 A 蒸气密度是相同状况下氢气密度的53倍,已知烃 A 不能使 Br2的 CCl4溶液褪色,但能使 KMnO4酸性溶液褪色。氢原子核磁共振谱表明A有2个吸收峰,强度之比为3 : 2;B只有一个吸收峰。 A 可以发生下图所示的一系列变化:
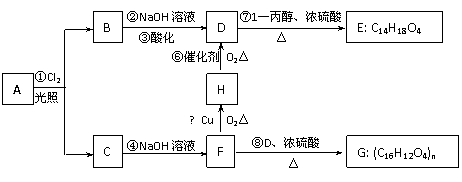
根据上述转化关系回答下列问题:
(l) 写出下列物质的结构简式: A ▲ G ▲ 。
(2) H、D 中含氧官能团的名称分别是 ▲ 、 ▲ 。
(3)化合物 F 分子中有 ▲ 个碳原子肯定共平面。
(4)写出反应⑦的化学反应方程式: ▲ 。
(5) F 不能发生的反应是 ▲ (填序号);
a.氧化反应 b.取代反应 c.消去反应 d.加成反应
写出 F 的同分异构体,且满足下列三个条件: a.结构稳定 b.与 F 具有相同官能
团且属同类物质 c.能发生消去反应。 F 的同分异构体为: ▲ 。
22. (12分)已知2SO2 (g)+ O2(g) 2SO3(g) △H =-196kJ·mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡。如下图所示:
(12分)已知2SO2 (g)+ O2(g) 2SO3(g) △H =-196kJ·mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡。如下图所示:
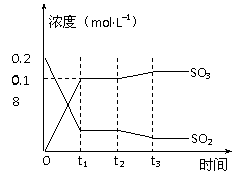
(22题图)
请回答下列问题:
(1)用O2表示2分钟内该反应的平均反应速率为 ▲ mol·L-1·min-1。计算500℃时该反应的平衡常数K= ▲ 。
(2)上图表示该反应在时刻t1达到平衡后,时刻t2因改变某个条件而发生变化的情况:
图中时刻t2发生改变的条件可能是 ▲ (写一个即可)。
(3)在上述条件下起始装入的SO2和O2各2mol,达平衡后设SO2的转化率为x,列出求x的方程 ▲ 。(不必求出x)
(4)某温度时,该反应的平衡常数K=800,则该温度 ▲ 500℃(填“>”、“<”、“=”)。
(5)500℃时,若起始装入的SO2、O2和SO3分别为0.2mol、y mol、wmol,达到平衡时各组分的含量与第(3)完全相同,则y= ▲ mol。刚开始时反应向 ▲ (填“正”或“逆”)反应方向进行。
21.(8分)A、B、C、D四种短周期元素,原子序数依次增大,A、D同主族,A、B的最外层电子数之和与C的最外层电子数相等, A与B、C分别能形成电子总数相等的分子,且A与C能形成常温下最为常见的液态化合物X。A、B两元素组成的化合物Y常温下为液态,其相对分子质量为32,是常用的火箭推进剂。
请回答下列问题:
(1)C元素的名称 ▲ 。
(2)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式
为: ▲ 。
(3)A、B、C三种元素形成一种盐,,其水溶液呈酸性的原因是(用离子方程式表示)
▲ 。
(4)1g Y在氧气中完全燃烧恢复至常温放出QkJ热量,写出Y在氧气中完全燃烧的热化学方程式: ▲ 。
20.在一定体积pH = 12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,
当溶液中的Ba2+恰好完全沉淀时,溶液pH = 11。若反应后溶液的体积等于Ba(OH)2溶
液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A.1∶9 B.1∶1 C.1∶2 D.1∶4
第Ⅱ卷(非选择题共60分)
19.一种新型的燃料电池以H2为燃料,熔融的K2CO3为电解质,该电池可同时供应电和水蒸气,其工作温度为600℃~700℃,已知该电池的总反应为:2H2+O2 = 2H2O,负极反应为:
H2+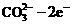 = H2O+CO2。现以该电池为电源对粗铜进行精炼。则下列推断正确的是
= H2O+CO2。现以该电池为电源对粗铜进行精炼。则下列推断正确的是
A.正极反应为:O2+2H2O+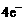 =
= 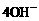 B.粗铜应该与电池中通H2的一极相连
B.粗铜应该与电池中通H2的一极相连
C.放电时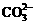 向正极移动
向正极移动
D.若能量的转化率为100%,电池中产生1 mol 水蒸气,可得纯铜64g
18.下列离子方程式正确的是
A.在碳酸氢镁溶液中加入足量 Ca(OH)2 溶液:
Mg2+ +2HCO3-+Ca2+ +2OH-=MgCO3↓ + CaCO3↓ + 2H2O
B.将0.5mol Cl2通入含2 mol FeBr2的溶液中:Cl2 + 2Fe2+ =2Fe3+ + 2Cl-
C.碳酸钡加入稀硫酸中:BaCO3+2H+=Ba2++CO2↑+H2O
D.Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3 H+ = Fe3+ + 3 H2O
17.有关AgCl沉淀溶解平衡的说法中,正确的是
A.当AgCl处于沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.在AgCl沉淀中加氨水,AgCl沉淀的溶解度增大,溶度积常数增大
C.升高温度,AgCl的溶解度增大,溶度积常数不变
D.向AgCl沉淀中加入NaCl饱和溶液,AgCl的溶解度减小,溶度积常数减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com