
题目列表(包括答案和解析)
22.已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得溶液呈酸性;0.01 mol·L-1的HIO3或HMnO4溶液与pH=12的Ba(OH)2溶液等体积混合所得溶液均呈中性,
(1)H5IO6是 (填“强电解质”或“弱电解质”)
(2)已知H5IO6和MnSO4在溶液中反应生成高锰酸、碘酸和硫酸,此反应中氧化剂是
(填化学式),反应的离子方程式为
21.在FeCl3稀溶液中滴加KSCN溶液后呈红色,反应的离子方程式是 。若先往FeCl3溶液中加入一些NaF溶液,再滴加KSCN溶液,则不呈红色,若再加入足够量FeCl3溶液.又会呈现红色.对这一现象有三种解释:
(1)F-能还原Fe3+,使之转化为Fe2+,(2)F-能与Fe3+结合成难电离的物质,
(3)F-能与SCN-反应,消耗了加入溶液中的SCN-。
对以上三种解释,你认为错误的是 ,理由是
19.(1)有常用玻璃仪器组成的下列六种实验装置(根据需要可在其中加入液体或固体)
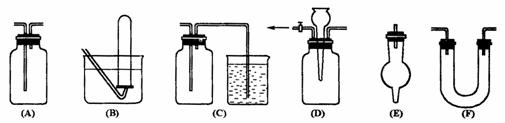
(1)能用做干燥二氧化硫气体的装置有 (填代号,下同)
(2)既能用于收集氯气又能用于收集一氧化氮气体的装置有
(3)在氯气和铁反应实验中,能添加在制气和化合反应装置之间以除去氯气中氯化氢等杂质气体的装置有
(4)在乙烯与溴水反应制二溴乙烷的实验中,能添加在制乙烯装置和加成反应装置之间,达到控制气流使其平衡目的的是 (5)若用C装置做二氧化硫与烧杯中氢氧化钠溶液反应实验,则其中广口瓶的作用是
|
20.将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如右图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下: |
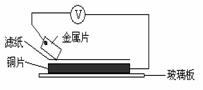 |
||||
|
金属 |
电子流动方向 |
电压(V) |
|
|
|
A |
A→Cu |
+ 0. 78 |
|
|
|
B |
Cu→B |
–0.15 |
|
|
|
C |
C→Cu |
+ 1.35 |
|
|
|
D |
D→Cu |
+0.30 |
|
|
已知:构成两电极的金属其金属活泼性相差越大,电压表的读数越大。
请依据表中数据判断:
(1) 金属可能是最强的还原剂; 金属一定不能从硫酸铜溶液中置换出铜。
(2)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到的蓝色沉淀析出的是 (填字母)金属。其对应的原电池的电极反应式为:
负极 ,正极 。
18.1.92g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积( )
A.504mL B.168mL C.336mL D.224mL
选择题答题处:
第Ⅱ卷(选择题共76分)
17.现有Na2CO3、H2SO4、Ba(OH)2三种物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,出现沉淀后过滤,再将滤液与第三种溶液混合起来,最终所得的溶液( )
A.一定呈酸性 B.可能呈碱性
C.可能呈中性 D.一定呈中性
16.已知:(l)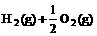 =H2O(g); △H1=a kJ·
=H2O(g); △H1=a kJ·
(2)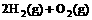 =2H2O(g); △H2=b kJ·
=2H2O(g); △H2=b kJ·
(3)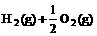 =H2O(l); △H3=c kJ·
=H2O(l); △H3=c kJ·
(4)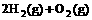 =2H2O(l); △H4=d kJ·
=2H2O(l); △H4=d kJ·
下列关系式中正确的是( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
15.在25ºC时,将两根铂电极插入一定量的硫酸钠饱和溶液中进行电解,当电路中有a mol电子转移时,溶液中析出mg Na2SO4 ·10 H2 O晶体。若温度不变,在剩余溶液中溶质的质量分数为( )
A.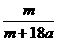 ×100%
B.
×100%
B.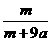 ×100%
×100%
C.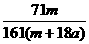 ×100%
D.
×100%
D.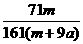 ×100%
×100%
14.根据等电子原理:由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,可互称为等电子体,它们具有相似的结构特征。以下各组微粒结构不相似的是( )
A.CO和N2 B.O3和NO- C.CO2和N2O D.N2H4和C2H4
13.将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是( )
A.Ca(OH)2的溶解度、溶剂的质量 B.溶液中溶质的质量分数
C.溶液的质量、水的电离平衡 D.溶液中Ca2+的数目、Ca(OH)2的溶解平衡
12.下列离子方程式或化学方程式中正确的是( )
A.氯气通入水中 Cl2 + H2O = 2H+ + Cl- + ClO-
B.向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+ ==Fe3++3H2O
C.向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3- == 3Fe3++NO↑+2H2O
D.向Mg(HCO3)2溶液中加入过量的苛性钠溶液:
Mg2++2HCO3-+2OH-==MgCO3↓ +CO32-+2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com