
题目列表(包括答案和解析)
19.下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是
|
|
(I) |
(II) |
|
A |
少量CO2通入Ca(OH)2溶液 |
过量CO2通入少量Ca(OH)2溶液 |
|
B |
少量浓氨水滴入Al2(SO4)3溶液 |
少量Al2(SO4)3溶液滴入浓氨水 |
|
C |
0.1mol Cl2通入含0.2mol FeBr2的溶液 |
0.3 molCl2通入0.2molFeBr2溶液中 |
|
D |
过量BaCl2溶液与少量Na2SO4溶液相混合 |
少量Ba(OH)2溶液与过量H2SO4溶液相混合 |
17.经测定某种溶液中只含NH4+、C1-、H+、OH-四种离子,下列说法错误的是
A.溶液中四种离子之间可能满足:c(C1-)>c(H+)>c(NH4+)>c(OH-)
B.若满足:c(NH4+)>c(C1-)>c(OH-)>c(H+),则溶质一定是NH4C1和NH3·H2O
C.若满足:c(C1-)=c(NH4+)>c(OH-)=c(H+),则溶质只有NH4C1
D.若满足:c(NH4+)=c(C1-),则溶液一定呈中性
|
①软锰矿、闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
|
③电解混合液:MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4
下列说法不正确的是
A.步骤①中MnO2和H2SO4都是氧化剂
B.步骤①中每析出12.8g S沉淀共转移0.8mol电子
C.电解时MnO2在阳极处产生
D.硫酸在生产中可循环使用
16.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
A.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3¯)>c(OH¯)
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3¯)>c(OH¯)>c(H+)
D.N3¯与CO2含相等电子数
15.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:
3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M。关于该反应的说法中不正确的组合是
A.氧化剂是H3AsO3 B. 每生成7.5gAs,还原剂失去的电子为0.3 mol
C.M为OH-; D.SnCl62-是氧化产物。
14.常温时,某无色溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该无色溶液中一定大量共存的离子组是
A.AlO2-、K+、NH4+、Na+ B.I-、Ca2+、HCO3-、Na+
C.MnO4-、SO42-、K+、Al3+ D.Na+、SO42-、Cl-、NO3-
13.下列每组物质发生状态变化所克服微粒间的相互作用属同种类型的是
A、食盐和蔗糖熔化 B、钠和硫熔化 C、碘和干冰升华 D、二氧化硅和氯化钠熔化
12.右图表示元素周期表的一部分,关于元素X、Y、Z、W的叙述正确的是
|
|
|
||
|
X |
|
|
|
|
Y |
|
Z |
|
|
|
W |
|
|
①X、Y的最高价氧化物的水化物酸性为Y<X
②Y、Z的气态氢化物的稳定性为Y<Z
③W的单质是半导体材料
④W的原子序数比Y大9
A.只有③ B.只有①③ C.只有①②③ D.①②③④
11.根据下表给出的几种物质的熔沸点数据,判断下列有关说法中错误的是





 物质 NaCl MgCl2 MCl3 SiCl4 单质B
物质 NaCl MgCl2 MCl3 SiCl4 单质B
 熔点 8100C 7100C 1800C -680C 23000C
熔点 8100C 7100C 1800C -680C 23000C
 沸点 14650C 14180C 1600C 570C 25000C
沸点 14650C 14180C 1600C 570C 25000C
 A、SiCl4是分子晶体 B、单质B可能是原子晶体
A、SiCl4是分子晶体 B、单质B可能是原子晶体
C、MCl3加热能升华 D、NaCl的键的强度比MgCl2小
9.可逆反应:2 NO2 2NO+O2在体积固定的密闭容器中进行,下列说法不能认为达到平衡状态的是
2NO+O2在体积固定的密闭容器中进行,下列说法不能认为达到平衡状态的是
A.单位时间内生成n mol的O2同时生成2n mol NO2
B.混合气体的颜色不再改变的状态
C.混合气体的密度不再改变的状态
D.混合气体的压强不再改变的状态
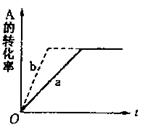 10.已知反应在密闭容器中进行,化学方程式为A(g)+2B(g) 3C(g)+D(s),反应放出热量。图中a曲线代表一定条件下该
10.已知反应在密闭容器中进行,化学方程式为A(g)+2B(g) 3C(g)+D(s),反应放出热量。图中a曲线代表一定条件下该
反应的过程。若使a曲线变为b曲线,可采取
的措施是
①增大A的浓度 ②缩小容器的容积
③加入催化剂 ④升高温度
A.①③ B.②④
C.②③ D.③④
8.NA表示阿伏加德罗常数,下列叙述中一定正确的是
A、1mol/LNaHCO3溶液中的Na+数为NA
B、常温常压下2.8g CO与N2混合气体所含的原子数为0.2NA
C、5.6g Fe与足量的稀盐酸反应,转移电子数为0.3NA
D、标准状况下0.1NA CCl4的体积约为2.24L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com