
题目列表(包括答案和解析)
8. 奥运会会标是五环旗,假定奥运五环旗中的
奥运会会标是五环旗,假定奥运五环旗中的
每一环表示一种物质,相连环物质间一定条件下
能发生常见反应,不相连环物质间不能发生反应。
且四种反应中必须包含化合反应、置换反应及
复分解反应,适合的一组是
|
选项 |
蓝 |
黑 |
红 |
黄 |
绿 |
|
A |
SiO2 |
CuSO4溶液 |
O2 |
NaOH溶液 |
Ag |
|
B |
O2 |
稀H2SO4 |
CO2 |
Fe |
NaOH溶液 |
|
C |
O2 |
稀H2SO4 |
Al(OH)3 |
NH3 |
NaOH溶液 |
|
D |
Mg |
CO2 |
KOH溶液 |
Al |
Fe2O3 |
7.同温同压下,对于等体积的一氧化氮(14N18O)和一氧化碳(13C18O)气体,下列说法正确的是:
A.含相同的质子和中子数
B.含相同的分子数和电子数
C.含相同的分子数和原子数
D.所含分子数和质量均不相同
6.最近,科学家用一种称为“超酸”的化合物H(CB11H8Cl60)和C60反应,得到一种新型离子化合物[HC60]+[CB11H6Cl2]-。这个很陌生物质生成的反应原理与我们中学化学中某个反应原理相类似。该反应是
A.Zn+H2 SO4= Zn SO4+H2 B.2Na+H2=2NaH
C.CO2+2NH3=CO(NH2) 2 +H2O D.NH3+HCl= NH4Cl
5.下列说法正确的是:①氯原子和氯离子性质一样;②+5价的氯原子只具有氧化性;③氯气具有氧化性,不具有还原性;④氯原子比氯离子少一个电子;⑤盐酸既具有氧化性、酸性,又具有还原性;⑥氯气的氧化性比盐酸的氧化性强
A.①②③ B.②③④ C.③④⑤ D.④⑤⑥
4.若50滴水正好是m mL,则1滴水所含的分子数是
A.m×50×18×6.02×1023
B.(m×50×18)/6.02×1023
C.(m/50×18)×6.02×1023
D.(m ×18/50)×6.02×1023
3.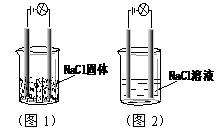 一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是
A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl溶液中水电离出大量的离子
D.NaCl在水溶液中电离出了可以自由移动的离子
2.下列有关物质分类或归类正确的是
①混合物:盐酸、漂白粉、水玻璃、水银
②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、石膏、冰醋酸、石炭酸
④同素异形体:C60、C70、金刚石、石墨
⑤同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑥同分异构体:乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯
A.①③④ B.②③④ C.③④ D.②④⑥
1.实验室里做钠跟水反应的实验时,用到的仪器和药品是
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤研钵 ⑥烧杯 ⑦坩埚 ⑧石棉网 ⑨玻璃片 ⑩药匙
A.①②③④ B.②③④⑥⑨ C.③④⑧⑨⑩ D.②⑤⑦⑨⑩
31.向一密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如附图一所示。附图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。

(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2)t4-t5阶段改变的条件为 ,B的起始物质的量为 。
该反应方程式可表示为
各阶段平衡时对应的平衡常数如下表所示:
|
t1-t2 |
t2-t3 |
t3-t4 |
t4-t5 |
t5-t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1= (保留两位小数),K1、K2、K3、K4、K5之间的关系为
K1 K2 K3 K4 K5 (用“>”、“<”或“=”连接)
(3)在相同条件下,若起始时容器中加入a molA、bmolB和cmolC,要达到t1时刻同
样的平衡(各物质的百分含量相同),a、b、c要满足的条件为 。
(含a,b,c的代数式表示)
附加题:(本题共10分)
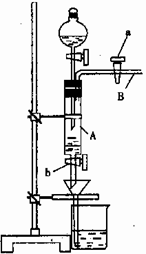 莫尔是一位著名分析化学家,以他命名的莫尔盐[ (NH4)2Fe(SO4)2·6H2O]是化学分析中重要的试剂,常作为一种稳定的还原剂使用。某同学模拟制备莫尔盐并利用莫尔盐测定高锰酸钾溶液的浓度。他的实验过程如下:
莫尔是一位著名分析化学家,以他命名的莫尔盐[ (NH4)2Fe(SO4)2·6H2O]是化学分析中重要的试剂,常作为一种稳定的还原剂使用。某同学模拟制备莫尔盐并利用莫尔盐测定高锰酸钾溶液的浓度。他的实验过程如下:
A中放有2g废铁屑(含铁锈,其他杂质不与稀硫酸反应),烧杯中盛有饱和硫酸铵溶液,实验时打开a,关闭b,从分液漏斗内向A中加一定量的稀硫酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后取烧杯内溶液倒入蒸发皿中加热,蒸发掉部分水,再降温结晶获得莫尔盐晶体。然后用莫尔盐测定未知高锰酸钾溶液的浓度。
试回答下列问题:
(1)请写出在蒸发皿中制得莫尔盐的化学方程式是:
(2)滴加稀H2SO4时,发现其反应速率比同浓度硫酸与纯铁粉反应快,其原因是 。
(3)取3.92g莫尔盐晶体配成100mL溶液,用酸式滴定管取20.00mL注入锥形瓶中,然后用未知浓度的酸性高锰酸钾溶液进行滴定,消耗该溶液的体积为8.00mL。
①配平下列反应式:
Fe2++ MnO4-+ H+ - Mn2++ Fe3++ H2O
②用 (酸式或碱式)滴定管盛装高锰酸钾溶液
③高锰酸钾溶液的物质的量浓度是 。
命题 校对 :高三备课组
30.10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
 温度(℃) 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大小”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 (填序号)。
A.Ba(OH)2溶液 B.BaC12溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 (填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断是错误的,理由是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com