
题目列表(包括答案和解析)
28.(8分)
为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图一、
图二所示的实验。
⑴图一可通过观察
定性比较得出结论。
有同学提出将CuSO4改为CuCl2更为合理,其理由是:
,
你认为还可以作何改进? 。
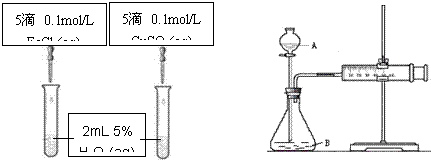
图一 图二
⑵检查图二装置气密性的方法是
图二所示实验中需测量的数据是 。
27.(10分)
有一瓶澄清的溶液,其中可能含有H+、NH4+、Mg2+、Ba2+、Al3+、I-、NO3-、CO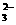 、SO
、SO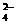 、AlO
、AlO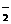 ,取该溶液进行以下实验:
,取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈酸性,可以排除 的存在。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4呈紫红色,可以排除 的存在。
(3)另取出部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,反应过程中均无沉淀产生,则又可排除 的存在。
(4)取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,证明有 的存在,又可以排除 的存在。
(5)根据上述实验事实可以确定,该溶液中肯定存在的离子是 ,还不能确定是否存在的离子是 。
26.(5分)
(1)已知氢氧化铁可以被次氯酸钠氧化成FeO4n-,当3.21gFe(OH)3参加反应时,反应中共转移了0.09mol电子,则n 。
(2)根据上题推断结果,配平下列离子方程式:
[ ]Fe(OH)3+[ ]ClO-+[ ]OH---[ ]FeO4n-+[ ]Cl-+[ ]H2O
(3)结合以上反应,推测FeO4n-能与下列哪些物质反应(填序号) 。
A.Cl2 B.SO2 C.H2S D.O2
25、(5分)
实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1) 配制250mL0.1mol/L的盐酸溶液。 应量取盐酸体积______mL ,应选用容量瓶的规格_______mL。 除容量瓶外还需要的其它仪:________________________________________________________。
(2) 配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___________________________________________________。
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约
30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3) 操作A中,将洗涤液都移入容量瓶,其目的是___________________________________________________________________
溶液注入容量瓶前需恢复到室温,这是因为__________________________________________________________________
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.加蒸馏水时不慎超过了刻度____________ ;b.定容时俯视_____________。
(5)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度 ? ______________________________________。
向容量瓶中转移溶液时(实验步骤B) 不慎有液滴掉在容量瓶外? _________。
24.(4分)
根据溴的性质,填写下列表格中关于液溴保存方法的选择及有关原因的解释:
①广口瓶 ②细口瓶 ③玻璃塞 ④橡皮塞 ⑤水封 ⑥煤油封 ⑦棕色瓶 ⑧无色瓶
|
|
选择保存方法 |
解释 |
|
(1) |
|
|
|
(2) |
|
|
|
(3) |
|
|
|
(4) |
|
|
23.(3分)对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、
蒸馏、萃取、渗析、加热分解等。下列各组混和物的分离或提纯应采用什么方法?
(1) 实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用
的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2) 实验室中制取的Fe(OH)3胶体中常常含有杂质Cl-离子。可
用 的方法除去Fe(OH)3胶体中混有的杂质Cl-离子。
(3)除去乙醇中溶解的微量食盐可采用 的方法。
(4)粗盐中含有不溶性的泥沙、可溶性的氯化钙、氯化镁及一些硫酸盐。对粗盐中的这些杂质可采用 和 的方法除去。
(5)除去氧化钙中的碳酸钙可用 的方法。
22.氯酸是一种强酸,室温下,浓度超过40%时就会发生分解,反应可表示为:a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
A. 由反应可确定:氧化性HClO4>HClO3
B. 若化学计量数a=8,b=3,则该反应转移电子数为18e-
C. 变蓝的淀粉碘化钾试纸褪色是因为可能发生了:5C12 + I2 + 6H2O = 12H+ + 10Cl- + 2IO3-
D. 若氯酸分解所得混合气体,lmol混合气体质量为52.5g,则反应方程式可表示为
26HClO3 = 15O2↑+ 8C12↑+ 10HClO4 + 8H2O
第Ⅱ卷(非选择题,共56分)
21.为达到预期的实验目的,下列操作正确的是
A. 欲配制质量分数为10%的ZnSO4溶液,将10 g ZnSO4·7H2O溶解在90 g水中
B. 欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C. 为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
D. 为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
20.设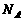 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是
A、23g钠与足量氧气充分反应,转移的电子个数为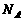
B、将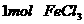 水解制成胶体,所得胶体的胶粒数为
水解制成胶体,所得胶体的胶粒数为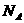
C.1mol Na2O2与水完全反应时转移电子数为2NA
D.18g D2O含有的电子数为10NA
19.某同学用回收的镁铝合金制取氢气。现有l0.8 g镁铝合金,下列说法正确的是
A. 常温下与足量18mol/LH2SO4反应,最多可放出0.6 mol H2
B. 常温下与足量2mol/LHNO3反应,最少可放出0.45 mol H2
C. 常温下与足量2 mol/L H2SO4反应,放出H2的量在0.45 mol-0.6 mol之间
D. 常温下与足量2mol/LNaOH反应,放出H2的量在0.45 mol-0.6 mol之间
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com