
题目列表(包括答案和解析)
7.已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均相对原子质量为192.22,这两种同位素的原子个数比应为:
A.39∶61 B.61∶39 C.1∶1 D.39∶11
6.下列变化过程,需要吸收能量的是:
A.H2→2H B.H+Cl→HCl C.Na+Cl→NaCl D.H2O(g)→H2O (l)
5.下表数据是对应物质的熔点(℃)
|
NaCl |
Na2O |
AlF3 |
AlCl3 |
BCl3 |
Al2O3 |
CO2 |
SiO2 |
|
801 |
920 |
1291 |
190 |
-109 |
2073 |
-57 |
1723 |
据此,下列判断错误的是:
A.AlF3晶体与AlCl3晶体的晶体类型相同
B.BCl3与CO2晶态时,均属分子晶体,且BCl3与CO2均为非极性分子
C.同族元素的化合物可形成不同类型的晶体
D.离子键的强弱与离子电荷的高低和半径的大小相关
4.将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是:
A.Ca(OH) 2的溶解度 B.溶质的质量分数
C.溶质质量 D.溶液中的Ca2+数目
3.对下列分子空间构型的判断正确的是:
A.H2O直线 B.NH3三角锥 C.CO2折线 D.CCl4正方形
2. 下列有关氧化物的说法正确的是:
A.凡是酸性氧化物,均可与水反应生成相应的酸。
B.金属氧化物都是碱性氧化物
C.与水反应生成酸的氧化物不一定是酸酐,与水反应生成碱的氧化物不一定是碱性氧化物
D.不能跟酸反应的氧化物,一定能跟碱反应
1. 下列物质按酸、碱、盐分类,排列正确的是:
A.硫酸、纯碱、石灰石 B.高锰酸、烧碱、绿矾
C.石炭酸、熟石膏、醋酸钠 D.磷酸、乙醇钠、苛性钾
31. (4分)
在500mLCuSO4和Fe2(SO4)3的混和溶液中加入21.7g 铁粉,待反应完全后,
得到16.8g残留固体。在滤液中加入400mL4mol / L的BaCl2溶液,恰好使
溶液中的SO42-完全沉淀。原混合物中CuSO4和Fe2(SO4)3的物质的量浓度分别
为 、 。
30.(6分)
(1)航天飞机曾用金属铝粉和高氯酸铵混合物作为固体燃料。加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解。m mol高氯酸铵分解时除产生2m mol水蒸气和m mol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力。
写出其中涉及到的化学方程式
;
。
(2)高氯酸铵作为火箭燃料的重要氧载体。高氯酸铵在高压、450℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气。
①写出此反应的化学方程式
。
②反应中生成的氧化产物与还原产物的物质的量之比是 ,
每分解1mol高氯酸铵,转移的电子数目是 。
29.(11分)
铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。

[探究一]实验方案:铝镁合金 测定剩余固体质量
实验中发生反应的化学方程式是
实验步骤:(1)称取5.4g铝镁合金粉末样品,投入VmL 2.0mol·L-1NaOH溶液中,充分反应。NaOH溶液的体积V≥
(1) 过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质
量分数将 (“偏高”或“偏低”)
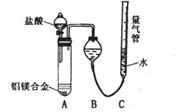

[探究二]实验方案: 铝镁合金 测定生成
气体的体积,实验装置如右图,问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间
添加一个干燥、除酸雾的装置。你的意见是:
(填“需要”或“不需要”)。
(2) 为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
① ②
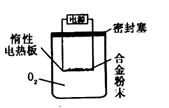 [探究三]实验方案:称量x g铝镁合金粉末.放在如右图
[探究三]实验方案:称量x g铝镁合金粉末.放在如右图
所示装置的惰性电热板上,通电使其充分灼烧。问题讨论:
(1) 欲计算Mg的质量分数,该实验中还需
测定的数据是
(2)若用空气代替O2进行实验,对测定结果是
否有影响? (填“是”或“否”)。
[实验拓展] 参照探究一、探究二实验方案,请你另设计一个实验方案,测定该铝镁合金中镁的质量分数。(书写形式可以模仿探究一、二)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com