
题目列表(包括答案和解析)
1.下列各组物质,前者是混合物,后者是纯净物的是 ( )
A.胆矾 玻璃 B.汽油 液氯 C.石油 盐酸 D.干冰 铝热剂
21.(12分)煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)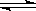 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数Kc |
9.94 |
9 |
1 |
试回答下列问题
(1)上述正向反应是: 反应(选填:放热、吸热)。
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D、E)。
|
|
A |
B |
C |
D |
E |
|
n(CO2) |
3 |
1 |
0 |
1 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
2 |
|
n(CO) |
1 |
2 |
3 |
0.5 |
3 |
|
n(H2O) |
5 |
2 |
3 |
2 |
1 |
(3)已知在一定温度下:C(s)+CO2(g) 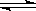 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g) 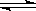 CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g)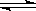 H2(g)+CO2(g) 平衡常数K2
,
H2(g)+CO2(g) 平衡常数K2
,
则K、K1、K2之间的关系是: 。
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020 mol/L,在该条件下,CO的最大转化率为: 。
(5)若在800℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y= 。
(6)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K= 。
20.(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)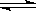 CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= (用 nB tB 表示)
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度减少 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
19.(10分)在一个固定体积为2升的密闭容器中,充入2 mol A和1
mol B,发生如下反应:2A(g)
+ B(g) 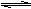 3C(g)
+ D(s),2分钟反应达到平衡,此时C的浓度为1.2
mol/L。
3C(g)
+ D(s),2分钟反应达到平衡,此时C的浓度为1.2
mol/L。
(1)写出该反应平衡常数的表达式 ,
2分钟内B 的平均反应速度为
(2)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________
(填“吸热”或“放热”)反应。
(3)若将容器体积缩小至1升,反应达到平衡时C的浓度为 mol/L/,平衡常数 (填增大、减小或不变)
18.(9分)工业制硫酸的核心反应是 :2SO2(g) + O2(g)  2SO3(g) △H<0,回答下列问题:
2SO3(g) △H<0,回答下列问题:
(1)此反应的平衡常数表达式为K= ,随着温度的升高,上述平衡常数 (填“增大”、“减小”或“不变”)。
(2)将一定量的SO2(g)和O2(g)放入1L密闭容器中,在一定条件下达到平衡,测得SO2为0.11mol,O2为0.05mol,SO3为0.12mol。计算该条件下,反应的平衡常数K= 。
SO2的转化为SO3转化率= 。
(3)体积不变的条件下,下列措施中有利于提高SO2的转化率的是
(填字母)。
A.通入氧气 B.移出氧气 C.增大压强
D.减小压强E.加入催化剂
(4)工业制硫酸的尾气中含有少量SO2 ,可先用氨水吸收,再用硫酸处理。
①反应的化学方程式为 ,
②这样处理的优点是
。
16.(6分)士兵在野外加热食物时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠,使用时加入水与其中的镁反应放出热量。下面是在形同的室温下对该产品的两个探究实验:
[实验1]向加有等量水的隔热容器中分别加入下列各组物质,结果参见下图1。
①1.0mol镁条、0.10mol铁粉、0.10mil氯化钠粉末;
②将1.0mol镁条剪成100份、0.10mol铁粉、0.10mil氯化钠粉末;
③1.0mol镁粉、0.10mol铁粉、0.10mil氯化钠粉末;

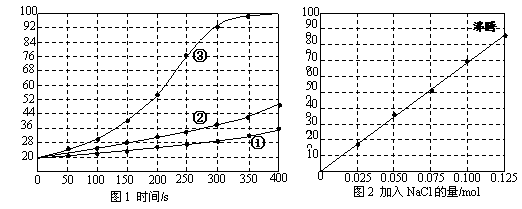
[实验2]向加有100mL水的隔热容器中分别加入0.10mol镁粉、0.50mol铁粉及不同量的
氯化钠粉末,不断搅拌,第15min时记录温度升高的幅度参见上图2。
请回答下列问题:
(1)实验1证实影响镁与水反应速率的主要因素是_________________。
A.反应温度 B.NaCl的用量 C.铁的用量 D.镁的表面积
(2)实验2中当NaCl的用量大于0.125mol时,实验就无须再做的原因是__________。
A.加入更多的NaCl不再增加反应速率 B.加入NaCl反而会降低反应速率
C.已达到沸点不再有温度变化 D.需要加入更多的铁粉来提高温度
(3)如果在实验2中加入了0.060molNaCl,则第15min时混合物的温度最接近于______。
A.34℃ B.42℃ C.50℃ D.62℃
(4)铁粉、NaCl能使反应速率增加的原因是______________________________________。17.(8分)氨在国民经济中占有重要的地位,请参与下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s) + H2O(g) 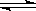 H2(g) + CO(g)
△H = +131.3 kJ ,△S = +133.7 J/K
H2(g) + CO(g)
△H = +131.3 kJ ,△S = +133.7 J/K
该反应在低温下能否自发 (填:能或否)。
(2)已知在400℃时,N2
(g)+ 3H2(g) 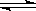 2NH3(g)的K=0.5,
2NH3(g)的K=0.5,
①2NH3(g)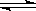 N2
(g)+
3H2(g)的K=
(填数值)。
N2
(g)+
3H2(g)的K=
(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)
(3)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能,1>2

14.已知一定温度下,X(g)+2Y(g) mZ(g);△H
=-akJ/mol(a>0)现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达平衡状态时,放出热量ckJ,且2b < c,则下列各值关系正确的是 ( )
mZ(g);△H
=-akJ/mol(a>0)现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达平衡状态时,放出热量ckJ,且2b < c,则下列各值关系正确的是 ( )
A.a = b B.2a < c C.m > 3 D.m < 3
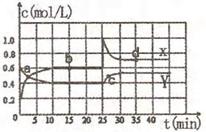 15.已知NO2和N2O4可以相互转化:
15.已知NO2和N2O4可以相互转化: △H
< 0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如右图。下列说法正确的是 ( )
△H
< 0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如右图。下列说法正确的是 ( )
A.图中的两条曲线,X是表示NO2浓度随时
间的变化曲线
B.前10min内用v(NO2)表示的化学反应
速率0.06mol/(L·min)
C.25min时导致平衡移动的原因是将密闭容
器的体积缩小为lL
D.a、b、c、d四个点中,只有a点的化学反应处于平衡状态
|
13.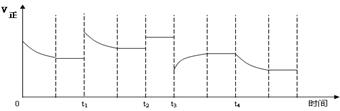 合成氨反应:N2(g)
+ 3H2(g)
合成氨反应:N2(g)
+ 3H2(g)  2NH3(g) △H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图:
2NH3(g) △H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图:
下列说法正确的是 ( )
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时增大了压强
D.t4时降低了温度
12.一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c
2Z(g),若X、Y、Z的起始浓度分别为c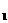 、c
、c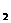 、c
、c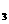 (均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是 ( )
(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是 ( )
A.c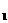 :c
:c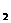 =1:3
=1:3
B.平衡时,Y和Z的生成速率之比为2:3
C.X、Y的转化率不相等
D.c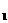 的取值范围为0.04<c
的取值范围为0.04<c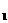 <0.14 mol/L
<0.14 mol/L
11.在某温度下,将2molA和3molB充入一密闭容器中,发生反应:
aA(g)+B(g) 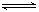 C(g)+D(g),5min后达到平衡,各物质的平衡浓度有如下关系: c a (A)×c(B)=c(C) ×c(D)。若在此温度下,将容器的体积扩大为原来的10倍,B的转化率不变,则此时A的转化率 ( )
C(g)+D(g),5min后达到平衡,各物质的平衡浓度有如下关系: c a (A)×c(B)=c(C) ×c(D)。若在此温度下,将容器的体积扩大为原来的10倍,B的转化率不变,则此时A的转化率 ( )
A.60% B.40% C.20% D.10%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com