
题目列表(包括答案和解析)
21.(8分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
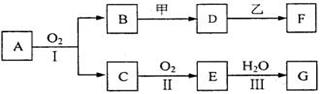
(1)若A为硫酸工业的重要原料,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应Ⅱ在 中进行(填设备名称),
工业上反应Ⅲ用于吸收E的试剂是 。
②反应I的化学方程式是 。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①甲的电子式是 。
②写出B和甲反应的化学方程式是 。
③若17gA与O2反应生成气态的B和C时放出226.7kJ热量,
写出该反应的热化学方程式: 。
20.(11分)Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z。
(1)Q的最高价氧化物,其固态属于______________晶体,俗名叫_______________;
(2)R的氢化物分子的空间构型是____________,属于________分子(填“极性”或“非极性”) ;它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是___________;
(3)X的常见氢化物的空间构型是________________;它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是__________________;
(4)Q分别与Y、Z形成的共价化合物的化学式是_________ 和__________;Q与Y形成的分子的电子式是________________,属于_________分子(填“极性”或“非极性”)。
19.(8分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素。已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍,在处于同周期的C、D、E三元素中,E 的原子半径最小,通常情况下,五种元素的单质中有三种气体两种固体。
(1)试比较D、E两元素的最高价氧化物对应的水化物的酸性强弱(填化学式):____>____
(2)A和B可形成原子个数比为1∶1的化合物,其电子式为____________。
(3)将E单质通入A、B、C三种元素组成的化合物的水溶液中,
写出反应的化学方程式__________________________________________________。
(4)写出两种均含A、B、C、D四种元素的化合物在溶液中相互反应且生成气体的离子方程式__________________________________________。
18.下列各组离子能在指定溶液中共存的是 ( )
①无色溶液中:K+、Cl-、Na+、H2PO4-、PO43-、SO42-
②使pH试纸变深蓝的溶液中:CO32-、NO3-、Na+、S2-、AlO2-、SO32-
③水电离的C(H+)=10-12mol·L-1的溶液中:ClO-、HCO3-、NO3-、NH4+、S2O32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42-
⑤使甲基橙变红的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
⑥pH=0的溶液中:Fe2+、Al3+、NO3-、I-、Cl-、S2-
A.①③ B.②④⑤ C.①②⑤ D.③⑥
17.为了实现我国政府在1997年12月31日前对淮河流域环境的治理,某甲、乙两相邻的工厂做了横向联合.已知两厂排放的污水经初步处理后,只溶有Ag+、Ba2+、Fe3+、Na+、Cl-、SO42-、NO3-、OH-中的各不同的4种离子(设各离子浓度比较大),若单独排放仍会造成环境污染,如将两厂的污水按适当的比例混合,沉淀后污水变成无色澄清的硝酸钠溶液排出,则污染程度会大为降低.你认为下列分析判断正确的是 ( )
A.SO42- 和NO3-可存在于同一工厂 B.Cl-和NO3-一定在不同的工厂
C.Ag+和Na+可能在同一工 D.Na+和NO3-来自同一工厂
16.有一瓶无色气体,可能含有H2S、CO2、HCl、HBr、SO2中的一种或几种,将其通入氯水中,得无色透明溶液,将这种溶液分为两份,向一份中加入用盐酸酸化的BaCl2溶液,出现了白色沉淀;向另一份中加入用硝酸酸化的AgNO3溶液,也产生了白色沉淀,与此有关的下列结论中,正确的是 ( )A.肯定有HCl、SO2 B.可能含有HBr、CO2
C.肯定没有CO2、H2S、HBr D.以上结论均不正确
15.用NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.0.1mol·L-1稀硫酸100mL中含有硫酸根离子个数为0.1NA
B.常温常压下,氧气和臭氧的混合物16g中含有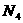 个氧原子
个氧原子
C.7.8 g Na2O2含有的阴离子数目为0.2 NA
D.NO2与足量的水完全反应,若有1molNO生成,则转移电子数为NA
14.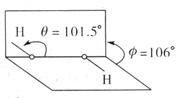 我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2·H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,下列说法不正确的是( )
我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2·H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供衍射实验的单晶体,经测定H2O2结构如图所示,结合以上信息,下列说法不正确的是( )
A.H2NCONH2与H2O2是通过氢键结合的
B.H2O2是极性分子
C.H2O2既有氧化性又有还原性
D.H2NCONH2·H2O2属于离子化合物
13.下列反应的离子方程式不正确的是 ( )
A.向烧碱溶液中滴加少量氯化铝溶液 Al3+ + 4OH- = AlO2- + 2H2O
B.物质的量相等的溴化亚铁跟氯气反应 2Fe2+ + 2Br- + 2Cl2 = 2Fe3+ + Br2 + 4Cl-
C.硫化钾晶体溶于水
S2- + 2H2O  2OH- + H2S
2OH- + H2S
D.向碳酸钠溶液中滴加过量的稀硫酸 CO32- + 2H+ = CO2↑+ H2O
12.下列说法正确的是 ( )
A.ⅠA族元素的金属性比ⅡA族元素的金属性强
B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com