
题目列表(包括答案和解析)
|
|
A |
B |
C |
D |
|
电解质溶液 |
HCl |
AgNO3 |
BaCl2 |
KOH |
|
PH值变化 |
减 小 |
增 大 |
不 变 |
增 大 |
22. (11分) 解析:(1)2片小苏打所含NaHCO3的质量为1g,其物质的量为=0.012mol,
由HCO3-+H+===CO2↑+H2O,可知n(H+)=0.012mol。
(2)6片小苏打的物质的量为:=0036mol,即中和的H+为0.036mol,而每片的Al(OH)3的物质的量为=0.0031mol,由Al(OH)3+3H+ ===Al3++3H2O,所以Al(OH)3的片数为:=3.8片。
(3)①碱式盐中加入HCl,首先是碱式盐中的OH-和CO32-与H+反应生成H2O和HCO3-,所以n(HCO3-)=2.0mol·L-1×0.0025L=0.005mol,即n(CO32-)=0.005mol,H+与CO32-与HCl反应的H+的总物质的量为:2.0mol·L-1×0.0425L=0.085mol,所以n(OH-)=0.08mol,它们的物质的量之比为:16∶1。
②能与过量的NaOH溶液反应产生沉淀的只有Mg2+,所以n[Mg(OH)2]==0.03mol,若碱式盐中不含结晶水,则氢元素的质量分数为:0.08mol×1g/mol=0.08g,氢元素的质量分数为:=0.027<0.04,说明碱式盐中含有结晶水,根据题意有:m(Al)+m(H2O)+0.03mol×24g/mol+0.005mol×60g/mol+0.08mol×17g/mol=3.01g,=0.04,所以m(H2O)=0.36g,n(H2O)=002mol,m(Al)=0.27g,n(Al)=001mol,所以n(Al3+)∶n(Mg2+)∶n(OH-)∶n(CO32-)∶n(H2O)=0.01mol∶0.03mol∶0.08mol∶0.005mol∶0.02mol=2∶6∶16∶1∶4,即碱式盐的化学式为:Al2Mg6(OH)16CO3·4H2O。
21.(12分) (1)2;10;8;5 ;2;1;8。(2)碱;KMnO4是强氧化剂,它会腐蚀乳胶管
(3)×100%;×100%。
18(8分)A: 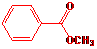 B:
B: 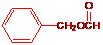
C: 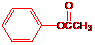 D:
D: 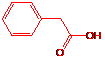
19(10分)(1) NaNO2 0.75mo1 (2) ②⑤ (3) ② NH4Cl + NaNO2 ==N2 ↑+ NaCl + 2H2O
20.(8分) (1)KHCO3 (2)2.4×1022 (3)碳(C)
(4)H2O2作氧化剂,其产物是H2O;H2O没有毒性及污染性。
22.(11分)小苏打、胃舒、平达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.5gNaHCO3,2片小苏打片和胃酸完全中和,被中和的H+是___________mol。
(2)胃舒平每片含0.245gAl(OH)3。中和胃酸时,6片小苏打片相当于胃舒平_____片。
(3)达喜的化学成分是铝和镁的碱式盐。
①取该碱式盐3.01g,加入2.0mol·L-1盐酸使其溶解,当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比。
②在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤,沉淀物进行干燥后重1.74g,若该碱式盐中氢元素的质量分数为0.040,试推测该碱式盐的化学式。
赣州三中2009届高三第二次月考答案
21.(12分)为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将a g铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580mL(标准状况);
方案二:将a/10 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000mol·L-1
的KMnO4溶液滴定,达到终点时消耗了25.00mL KMnO4溶液。请回答下列问题:
(1)配平下面的化学方程式并标出电子转移的方向和数目:
□KMnO4+□FeSO4+□H2SO4=□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
(2)在滴定实验中不能选择 式滴定管,理由是 ;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为:
和 ;(铁的相对原子质量以55.9计)
20.(8分)“绿色试剂”双氧水可作为矿业废液消毒剂,如要消除采矿业废液中的氰化物(如KCN),化学方程式为:KCN+H2O2+H2O=A+NH3↑
(1)生成物A的化学式为 。
(2)在标准状况下有0.448L氨气生成,则转移的电子数为 。
(3)反应中被氧化的元素为 。
(4)H2O2被称为绿色氧化剂的理由是 。
19. (10分)已知NaNO2能发生如下反应: 2NaNO2+4HI=2NO+I2+2NaI+2H2O。
(1)上述反应的氧化剂是 。若有0.75mo1的还原剂被氧化,则被还原的氧化剂是 mol。
(2)NaNO2有像食盐一样的咸味,误食会使人中毒,可以用试剂和生活中常见的物质进行实验鉴别NaNO2和 NaCl,现有物质①自来水 ②碘化钾一淀粉试纸 ③淀粉 ④白糖 ⑤食醋 ⑥白酒 ,在进行实验时,必须选用的物质有 (填编号)。
(3)某厂废液中含2%的NaNO2,直接排放会造成污染,下列试剂中: ①NaCl ②NH4C1 ③H2O2 ④浓H2SO4 能使NaNO2转化为不引起二次污染物质N2的是 (填编号),反应的化学方程式为 。
18.(8分)化合物A、B、C和D互为同分异构体,分子量为136,分子中只含碳、氢、氧,其中氧的含量为23.5%。实验表明:化合物A、B、C和D均是一取代芳香化合物,其中A、C和D的芳环侧链上只含一个官能团。4个化合物在碱性条件下可以进行如下反应:
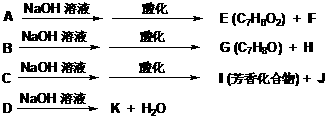
试画出A、B、C和D的结构简式:
A: B:
C: D:
第II卷 (非选择题 共49分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com