
题目列表(包括答案和解析)
8.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应2FeC13+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
7.我国古代制得的“药金”外观和金相似,常被误认为是金子。冶炼方法是:将炉甘石(ZnCO3)和赤铜矿(Cu2O)与木炭按一定比例混合,加热至800℃左右,即炼出闪着似金子般光泽的“药金”。有关叙述正确的是
①“药金”是铜锌合金 ②冶炼过程中炉甘石直接被碳还原而有锌生成 ③用火焰灼烧可区分黄金与“药金”④用王水可以区分黄金与“药金”⑤表面有黑色氧化物的“药金”,用稀硫酸洗涤后可去掉黑色膜,但可能发出铜红色
A.①② B.①②③④ C.①③④⑤ D.①②③④⑤
6.重金属离子有毒性。实验室有甲、乙两种废液,均有一定毒性。甲废液经化验呈碱性,主要有毒离子为Ba2+,如将甲、乙两废液按一定比例混合,毒性明显降低。乙废液中可能含有的离子是 ( )
A.Cu2+和SO42- B.Cu2+和Cl- C.K+和SO42- D.Ag+和NO3-
5.已知铍(Be)的原子序数为4。下列对铍及其化合物的叙述中,正确的是
A.铍的原子半径小于硼的原子半径 B.氯化铍分子中铍原子的最外层电子数是8
C.氢氧化铍的碱性比氢氧化钙弱 D.单质铍跟冷水反应产生氢气
4.制备卤磷酸钙荧光粉所用的高纯氯化钙中混有镁杂质,除去的方法是把氯化钙的水溶液加热到90-95℃,在不断搅拌下加入适当的沉淀剂,使镁生成沉淀过滤除去。此沉淀剂最好选用 ( )
A.氢氧化钙乳浆 B.碳酸钠溶液 C.碳酸氢钠溶液 D.氢氧化钠溶液
3.定向爆破建筑物时,应同时定向切断钢筋和炸碎水泥,除要用适宜的猛烈炸药外,还需用 ( )
A.氧炔焰 B.铝热剂 C.液氧 D.电弧
2.下列灭火剂能用于扑灭金属钠着火的是
A.干冰灭火剂 B.黄沙 C.干粉灭火剂(含NaHC03) D.泡沫灭火剂
1.微量元素是指在人体内总含量不到万分之一,重量总和不到人体重量的千分之一的20多种元素,这些元素对人体正常代谢和健康起着重要作用,下列各组元素全部属于微量元素的是 ( )
A.Na,K,Cl,S,O B.F,I,Fe,Zn,Cu
C.N,H,0,P,C D.Ge,Se,Ca,Mg,C
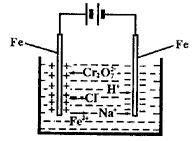
(1)电解时的电极反应:阳极______________,阴极______________。 (2)Cr2O72-转变成Cr3+的离子反应方程式:______________。 (3)电解过程Cr(OH)3和Fe(OH)3沉淀是怎样产生的? (4)能否用Cu电极来代替Fe电极?______________(填“能”或“不能”),简述理由。 19.下图为持续电解饱和CaCl2水溶液(含酚酞)的装置(以铂为电极,A为电流表),电解一段时间后,在左图中从1小时起将CO2连续通入电解液中,请在右图中完成实验中电流对时间的变化关系图,并回答有关问题。
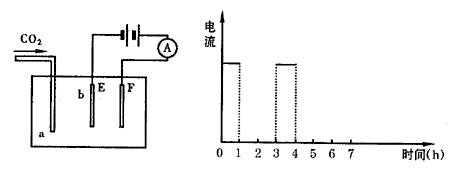
(1)电解时F极发生______反应,电极反应式为______;E极发生______反应,电极反应式为______;电解方程式为______。 (2)电解池中产生的现象:①______,②______,③______。 20.工业上用MnO2和KOH为原料制取KMnO4,主要生产过程分为两步进行:第一步将MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4的浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。 (1)制取K2MnO4的反应方程式是__________,连续搅拌的目的是__________。 (2)电解K2MnO4的浓溶液时,两极发生的电极反应式,阴极是__________,阳极是__________;电解方程式是__________。 五、(本题包括2小题,共16分) 21.某硝酸盐晶体的化学式为M(NO3)x·nH2O,其式量为242。将1.21g该晶体溶于水制成100mL溶液,用惰性电极进行电解,当有0.01mol电子转移后,可使金属离子还原,析出0.32g金属。求:(1)金属的相对原子质量及x、n的值。(2)电解后溶液的pH。 22.由于Fe(OH)2极易被氧化.所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。应用如图4-18所示电解实验可制得白色纯净的Fe(OH)2沉淀。两电极的材料分别为石墨和铁。
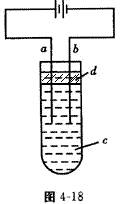
(1)a电极材料应为______,电极反应式为______。
(2)电解液C可以是______(填编号)。
A.纯水
B.NaCl溶液
C.NaOH溶液
D.CuCl2溶液
(3)d为苯,其作用为__________,在加入苯之前对C应做何简单处理?__________。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号)______。
A.改用稀硫酸作电解液
B.适当增大电源的电压
C.适当减小两电极间距离
D.适当降低电解液的温度
(5)若C为Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源来电解,除了电极上看到气泡外,混合物中另一明显现象为__________。
六、(本题包括2小题,共19分)
23.对于柯尔贝反应: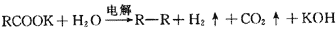 (R代表烃基;未配平)。在电解过程中生成的H2和CO2的体积之比是(在相同条件下):_______。
24.(1)当电源通过2L 6%的KOH溶液(密度为:1.05g/mL)时,溶液的浓度改变了2%,此时阳极析出的物质是什么?质量为多少克?
(2)若电解后溶液不小心混入KCl杂质,为了除去杂质又进行电解,当有5.6L(标况)Cl2析出,可认为电解作用是完全的,求最后所得溶液中KOH的质量分数为多少?
(R代表烃基;未配平)。在电解过程中生成的H2和CO2的体积之比是(在相同条件下):_______。
24.(1)当电源通过2L 6%的KOH溶液(密度为:1.05g/mL)时,溶液的浓度改变了2%,此时阳极析出的物质是什么?质量为多少克?
(2)若电解后溶液不小心混入KCl杂质,为了除去杂质又进行电解,当有5.6L(标况)Cl2析出,可认为电解作用是完全的,求最后所得溶液中KOH的质量分数为多少?
|
|
阳 极 |
阴 极 |
溶液甲 |
物质乙 |
|
A |
Pt |
Pt |
NaOH |
NaOH固体 |
|
B |
Pt |
Pt |
H2SO4 |
H2O |
|
C |
Pt |
Pt |
NaCl |
NaOH |
|
D |
粗 铜 |
精 铜 |
CuSO4 |
Cu(OH)2 |
8.如图所示,四种装置工作一段时间后,测得导线上均通过了0.002mol电子,此时溶液的pH由小到大的排列顺序为(不考虑水解和溶液的体积变化)( )
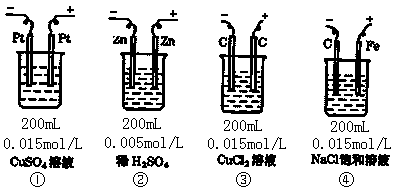
A.①<③<②<④
B.②<①<③<④
C.②<①<④<③
D.①<②<④<③
9.用惰性电极分别电解下列各物质水溶液一段时间后,向剩余电解质溶液中加入适量水能使溶液恢复到电解前浓度的是( )
A.AgNO3
B.Na2SO4
C.CuCl2
D.KCl
10.将两个铂电极插入500mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064g(设电解时该电极无氢气析出,且不考虑水解和溶液体积的变化)。此时溶液中氢离子浓度约为( )
A.4×10-3mol/L
B.2×10-3mol/L
C.1×10-3mol/L
D.1×10-7mol/L
11.在25℃时,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,在阳极逸出amol气体,同时有WgNa2SO4·10H2O晶体析出,若温度不变,此时剩余溶液中溶质的质量分数是( )
A.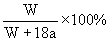 B.
B.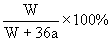 C.
C.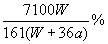 D.
D.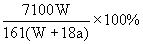 12.X、Y、Z、M代表四种金属,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气析出;若电解含Y2+离子和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子。则这四种金属的活动性由强到弱的顺序为( )
A.X>Z>Y>M
B.X>Y>Z>M
C.M>Z>X>Y
D.X>Z>M>Y
13.目前,人们正在研究开发一种高能电池--钠硫电池,它是以熔融的钠、硫为两极,以Na+导电的β-Al2O3陶瓷作固体电解质,反应式如下
12.X、Y、Z、M代表四种金属,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气析出;若电解含Y2+离子和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子。则这四种金属的活动性由强到弱的顺序为( )
A.X>Z>Y>M
B.X>Y>Z>M
C.M>Z>X>Y
D.X>Z>M>Y
13.目前,人们正在研究开发一种高能电池--钠硫电池,它是以熔融的钠、硫为两极,以Na+导电的β-Al2O3陶瓷作固体电解质,反应式如下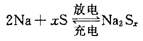 ,以下说法正确的是( )
A.放电时,Na作正极,S作负极
B.充电时钠极与外电源的正极相连
C.若用此电池电解硝酸银溶液时,当阳极上产生标准状况下气体1.12L时,消耗金属钠4.6g
D.充电时,阴极发生的反应为:Sx2--2e-=xS
14.用惰性电极电解VL某二价金属的硫酸盐溶液一段时间后,阴极有Wg金属析出,溶液的pH从6.5变为2.0(体积变化可以忽略不计)。析出金属的相对原子质量为( )
A.
,以下说法正确的是( )
A.放电时,Na作正极,S作负极
B.充电时钠极与外电源的正极相连
C.若用此电池电解硝酸银溶液时,当阳极上产生标准状况下气体1.12L时,消耗金属钠4.6g
D.充电时,阴极发生的反应为:Sx2--2e-=xS
14.用惰性电极电解VL某二价金属的硫酸盐溶液一段时间后,阴极有Wg金属析出,溶液的pH从6.5变为2.0(体积变化可以忽略不计)。析出金属的相对原子质量为( )
A. B.
B.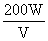 C.
C.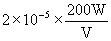 D.
D.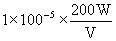 15.以铁为阳极、铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2molFe(OH)3沉淀,此时消耗水的物质的量共为( )
A.2mol
B.3mol
C.4mol
D.5mol
15.以铁为阳极、铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2molFe(OH)3沉淀,此时消耗水的物质的量共为( )
A.2mol
B.3mol
C.4mol
D.5mol
第 Ⅱ 卷
(非选择题,共90分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com