
题目列表(包括答案和解析)
35.从石油裂解中得到的1,3-丁二烯可进行以下多步反应,得到重要的合成橡胶和杀菌剂富马酸二甲酯。
 (1)写出D的结构简式
(1)写出D的结构简式
(2)写出B的结构简式
(3)写出第②步反应的化学方程式
(4)写出富马酸的一种相邻同系物的结构简式
(5)写出第⑨步反应的化学方程式
(6)以上反应中属于消去反应的是 (填入编号)。
34.酚是重要的化式原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。
已知:
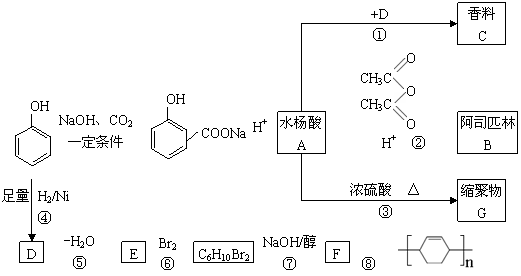 + + CH3COOH
+ + CH3COOH
(1)写出C的结构简式 。
(2)写出反应②的化学方程式 。
(3)写出G的结构简式 。
(4)写出反应⑧的化学方程式 。
(5)写出反应类型:④ ⑦ 。
(6)下列可检验阿司匹林样品中混有水杨酸的试剂是 。
(a) 三氯化铁溶液 (b) 碳酸氢钠溶液 (c)石蕊试液
33. (A)我国化学侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
(A)我国化学侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
(1) 上述生产纯碱的方法称 ,副产品的一种用途为 。
(2) 沉淀池中发生的化学反应方程式是 。
(3) 写出上述流程中X物质的分子式 。
(4) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(6) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
(a) 增大NH4+的浓度,使NH4Cl更多地析出 (b) 使NaHCO3更多地析出
(c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
32、海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)海水中含有大量的氯化钠。氯化钠中的金属元素位于元素周期表第 族。
(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填物理变化、化学变化)
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
 食盐+H2O
NaOH+H2+Cl2(未配平)。该反应中食盐的化学式是
。利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐
t。
食盐+H2O
NaOH+H2+Cl2(未配平)。该反应中食盐的化学式是
。利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐
t。
|

写出②④的化学反应方程式:
上述亚硫酸氢钠与甲醛经过一定反应,可以合成俗称“吊白块”(雕白粉)的物质。因吊白块对人体有害,不能用于食品漂白。其结构简式为:HOCH2SO3Na,根据其结构特点,吊白块能发生的反应有:
A.皂化反应 B.聚合反应 C.与金属钠反应 D.氧化反应
31、在某些酶的催化下,人体内葡萄糖的代谢过程如下:
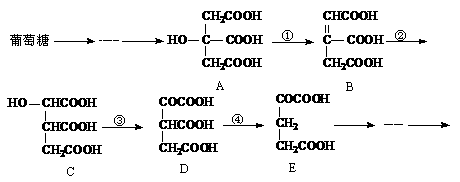

(1)过程①、②、③的反应类型分别是①____________②_____________③____________。
(2)根据质量守恒定律推测,过程④的另一种生成物是____________(填化学式)。
(3)上述五种物质中,_________和__________互为同分异构体(填A~E序号)。
(4)葡萄糖是多羟基的醛,写出它与新制氢氧化铜发生反应的化学方程式:
___________________________________________________________________
(5)在有机物中,若分子中有一个或若干个碳原子以四个单键与四个不同的原子或原子团
相连,该有机物就有“对映异构体”。以上A~E物质中有对映异构体的是__________(填A~E序号)。
30.煤粉在隔绝空气中加强热,除主要得到焦炭外,还能得到下表所列的物质:
|
序号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
名称 |
甲烷 |
一氧化碳 |
乙烯 |
苯 |
甲苯 |
苯酚 |
氨水 |
(1)表中所列物质不属于有机物的是(填序号): 。
(2)能使溴水褪色的是(填序号): 。
(3)能发生加聚反应、生成物可用作制造食品包装袋的是(填序号) ,该物质发生加聚反应的化学方程式为: 。
(4)能使氯化铁溶液变为紫色的是(填序号): 。
(5)甲苯的一氯取代产物的有 种。
29.有机物X( )广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多。
(1)有机物中含有的官能团名称是 ;在一定条件下有机物X可发生化学反应的类型有 (填序号);
A.水解反应 B.取代反应 C.加成反应 D.消去反应
E.加聚反应 F.中和反应
(2)下列物质与X互为同分异构体的是 (填序号);
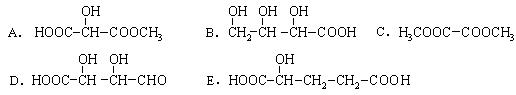
(3)写出X与金属钠发生反应的化学方程式: ;
(4)写出X与氧气在铜作催化剂加热的条件下发生反应所得的可能产物的结构简式 。
28.某化学兴趣小组模拟测定工业原料气SO2、N2、O2混合气体中SO2含量,选用了下列简易实验装置:
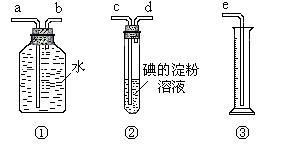
(1)若原料气从左向右流向时,上述装置组装连接的顺序是:
原料气→ (填a、b、c、d、e)。
(2)装置②中发生反应的离子方程式为 ;当装置②中出现 现象时,立即停止通气。若此时没有及时停止通气,则测定的SO2含量 (选填“偏高”、“偏低”或“不受影响”)。
(3)你认为下列试剂中,可以用来代替试管中的碘的淀粉溶液的是 (填编号)
A.酸性KMnO4溶液 B.NaOH溶液 C.溴水 D.氨水
(4)若碘溶液的浓度为0.05mol/L、体积为20mL,收集到的N2和O2的体积为297.6mL(已折算为标准状况的体积)。SO2的体积分数为 。
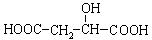
27.盐酸、硫酸和硝酸是三种重要的酸。 (1)工业上生产盐酸与硝酸时,都要用到的气态反应物是_______; (2)工业上生产硫酸与硝酸时,用到的相同的重要设备是_______; (3)工业生产中欲制得高浓度的硫酸与硝酸,可使用的相同物质是_______; (4)浓盐酸与浓硝酸暴露在空气中,相同的现象是_______; (5)浓硫酸与浓硝酸都可用铁、铝容器贮存的相同原理是_______; (6)实验室制备H2、CO2、H2S、SO2时,用盐酸和浓硫酸可制备的相同气体是_______。
26.下面实验中需要使用温度计的是……( ) A、制溴苯 B、制硝基苯 C、乙醛的银镜反应 D、制酚醛树脂 E、测定硝酸钾的溶解度 F、分馏石油 G、纤维素水解 H、制乙烯 I、制乙酸乙酯 J、用新制氢氧化铜悬浊液检验葡萄糖
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com