
题目列表(包括答案和解析)
24.(11分)(1)“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为N2O与CO2分子具有相似的结构(包括电子式);又已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示为 ,由此可知它 (填“含有”或“不含”)非极性键。
(2)长期以来一直认为氟的含氧酸不存在。自1971年美国科学家用F2通过细冰末获得HFO(次氟酸)以来,对HFO的研究引起重视。
①HFO的电子式为 ,写出HFO的结构式,并标出HFO中各元素的化合价 。
②次氟酸的名称是否妥当?为什么? 。
③次氟酸能与水反应生成两种物质,其中有一种物质常用于雕刻玻璃,试写出次氟酸与水反应的化学方程式为 。
23.(8分)水是生命之源,它与我们的生活密切相关。在化学实验中,水也是一种常用的试剂。
(1)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+),其中含有的化学键有 、 。
(2)冰是立方面心结构。下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)
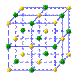

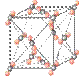
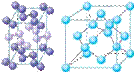
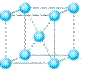
A B C D E
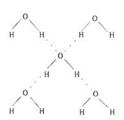
(3)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热(即1mol水由冰转化为水蒸汽所需能量)是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”(破坏1mol氢键所需的能量即为氢键的“键能”)是 kJ/mol;
22.(6分)钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,
被誉为“未来世界的金属”, 钛有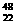 Ti和
Ti和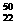 Ti两种原子,它们互称为
。Ti元素在元素周期表
Ti两种原子,它们互称为
。Ti元素在元素周期表
中的位置是第 周期,第 族;基态原子的电子排布式为 ;
按电子排布Ti元素在元素周期表分区中属于 区元素。
21.(14分)有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金
属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的
p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回
答下列问题:
(1)A是________,B是________,C是________,D是________,E是_________。
(2)C、D、E四种元素的简单离子按半径由小到大的顺序为(用离子符号表示)__________________________。
(3)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是
___________。(填﹥、﹤、﹦,用元素符号表示)
(4)用轨道表示式表示D元素原子的价电子构型____________________。
(5)写出A和B按原子个数比1 : 1形成的化合物的电子式 。
(6)用电子式表示D和E形成离子化合物的形成过程 。
20.(12分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
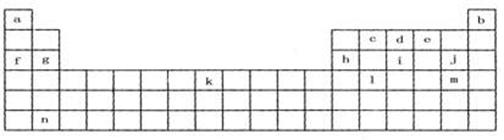
(1)上表所列元素中,原子最外层只有2个电子的短周期元素是(填元素符号) ;
元素j的最高氧化物的化学式为 ,元素i最高氧化物的水化物的化学式为 。
(2)已知与f在同一周期的元素R位于第p主族,则R的原子序数为(用p的代数式表示) ,R能形成气态氢化物,其氢化物的化学式为 。
(3)根据构造原理,写出m原子的外围电子排布式_____________________。
19.通常情况下,原子核外p能级、d能级等原子轨道上电子排布为“全空”、“半满”、“全满”的时候一般更加稳定,称为洪特规则的特例。下列事实能作为这个规则证据的是( )
A、元素氦(He)的第一电离能远大于元素氢(H)的第一电离能
B、26Fe2+容易失电子转变成26Fe3+,表现出较强的还原性
C、基态铜(Cu)原子的电子排布式为[Ar]3d104s1而不是[Ar]3d94s2
D、某种激发态碳(C)原子排布式为1s22s12p3而不是1s22s22p2
Ⅱ卷(共63分)
18. A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素的下列叙述:
①原子半径A<B;②离子半径A>B;③原子序数A>B;④原子最外层电子数A﹤B;⑤A 的正价与B的负价绝对值一定相等;⑥A的电负性小于B的电负性;⑦A的第一电离能大于B的第一电离能。其中正确的组合是 ( )
A.①②⑦ B.③④⑥ C.③⑤ D.③④⑤⑥⑦
17. 下列说法不正确的是 ( )
A.元素周期表中的周期是单调的,每一周期里元素的数目一样多
B.元素周期表中同一横行的短周期中,其能层数相同,最外层电子数不同
C.元素周期表中同一纵行的主族元素,其能层数不同,最外层电子数相同
D.所有周期的元素都是从碱金属元素开始,以稀有气体元素结束
16. 下列能够用“键能”解释的有( )
A、N2参加反应时,多数需要“高温、高压、催化剂”等苛刻的条件
B、稀有气体一般与其它物质很难发生化学反应
C、常温常压下;氯气呈气态,溴呈液态
D、HF比HCl稳定,其水溶液的酸性比HCl弱
15.下列各组原子,彼此性质一定相似的是 ( )
A、1s2与2s2的元素
B、M层上有两个电子与N层上有两个电子的元素
C、2p上有一个未成对电子与3p上有一个未成对电子的元素
D、L层上有一个空轨道和M层的p轨道上有一个空轨道的元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com