
题目列表(包括答案和解析)
1、下列关于铜电极的叙述不正确的是( )
A、铜锌原电池中铜是正极 B、用电解法精炼铜时粗铜作阳极
C、在镀件上镀铜时可用铜作阳极 D、电解稀H2SO4制H2、O2时铜做阳极
0.1mol/L×10×103L x
所以,x=0.1mol/L×10×103L=1000mol
故,该工厂产生的尾气中SO2气体的体积分数是
(1000mol×22.4L/mol)/89.6×103L×100%=25%
答:该工厂产生的尾气中SO2气体的体积分数是25%。
21.用Na2SO3可以治理工业SO2尾气污染,这是一种治理SO2尾气污染比较新颖的方法。具体操作是:①将含有SO2气体的工厂尾气通入到Na2SO3溶液中,使其吸收含有尾气中的SO2气体;②将富集有SO2气体的溶液加热,即可使其中的SO2气体逸出,这些SO2气体可以应用于制取H2SO4。该方法中Na2SO3可以循环使用,符合绿色化学的基本原则。请根据上述信息解答下列试题:
(1)写出①、②两步的化学方程式
① ;
② 。
(2)今有10m3的0.1mol/L的Na2SO3溶液,每次吸收标准状况下的含有SO2气体的尾气89.6m3后,即达到了饱和状态。试求该工厂产生的尾气中SO2气体的体积分数是多少。
解:(1)①Na2SO3+SO2+H2O=2NaHSO3
②2NaHSO3
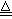 Na2SO3+SO2↑+H2O
Na2SO3+SO2↑+H2O
(2)设每次吸收的SO2的物质的量为x
Na2SO3 + SO2+ H2O = 2NaHSO3
1 1
20.全球海水中溴的藏量丰富,约占地球溴总藏量的99%,故溴有“海洋元素”
之称,海水中溴含量为65mg/L。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及到的反应有:① (写出离子方程式);②Br2+3CO32-=BrO3-+ 5Br-+3CO2↑;③BrO3-+ 5Br-+6H+=-3Br2+3H2O。其中反应②中氧化剂是 ;还原剂是 。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫的离子反应方程式:_ ______________ __。
(3)溶剂萃取法。该法是利用单质溴在水中和溶剂中溶解度的不同的原理来进行的。实验室中萃取用到的实验仪器名称是 。下列可以用于海水中溴的萃取试剂的 。
①乙醇 ②四氯化碳 ③硝酸 ④裂化汽油
答案:(1)Cl2+2Br-=2Cl-+Br2 ;Br2(2)Br2+SO2+2H2O=2HBr+H2SO4;(3)分液漏斗 ②。
19、B 为了检验淀粉的水解情况,某同学设计了以下三个实验方案。并根据实验现象,得出了相应的结论:
方案A: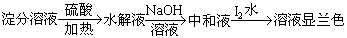
结论:淀粉完全没有水解
方案B: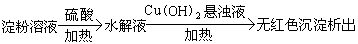
结论:淀粉完全没有水解
方案C: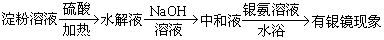
结论:淀粉已经水解完全了
根据上述操作,现象首先回答结论是否正确,然后简要说明理由
(1)方案A 。
(2)方案B 。
(3)方案C 。
答案:(1)结论不正确。如果淀粉只是发生部分水解,未水解的淀粉遇碘(I2)也会呈蓝色。
(2)结论不正确。如果淀粉发生水解会生成葡萄糖,但由于水解液没有用NaOH溶液中和,所以加入的Cu(OH)2会溶于硫酸,从而无法氧化葡萄糖,也就无红色沉淀生成,但淀粉水解了。
(3)结论不正确,实验只能证实淀粉已经或正在发生水解,没有证明是否仍有淀粉存在。所以无法证明淀粉水解完全。
25.氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2·nH2O的含量。
(1)称取3.50 g试样溶于蒸馏水配成100 mL溶液,从中取出10.0 mL溶液于锥形瓶中,与0.100 mol / L HCl标准溶液反应,完全反应共消耗标准液20.0 mL(杂质不与酸反应),求试样中氢氧化钡的物质的量。
(2)另取5.25 g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09 g,求Ba(OH)2·nH2O中的n值。
(3)试样中Ba(OH)2·nH2O的质量分数为
24.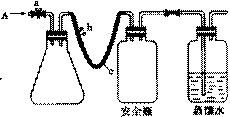 (16分)实验室用下列方法测定某水样中O2的含量。
(16分)实验室用下列方法测定某水样中O2的含量。
(1)用如右图所示装置,使水中溶解的O2,在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为
。
① 打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是 。
② 用注射器抽取20.00 mL 某水样从A 处注人锥形瓶。
③ 再分别从A 处注入含m molNaOH的溶液及过量的MnSO4 溶液。
④ 完成上述操作后,下面应进行的操作是 。
c是长橡胶管,使用较长橡胶管的目的是 。
(2)用I- 将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为:MnO(OH)2+2I-+4H+
==Mn2++I2+3H2O。实验步骤:
⑤ 打开止水夹a、b,分别从A 处注人足量NaI溶液及含n mol H2SO4的硫酸溶液。
⑥ 重复④ 的操作。
(3)用Na2S2O3 标准溶液滴定步骤(2)中生成的I2,反应方程式为:
I2+2Na2S2O3==2NaI+Na2S4O6。
实验步骤:
⑦ 取下锥形瓶,向其中加入2-3滴 作指示剂。
 ⑧ 用0.005 mol · L-1Na2S2O3 滴定至终点。
⑧ 用0.005 mol · L-1Na2S2O3 滴定至终点。
(4)计算。滴定过程中,滴定前后滴定管中的液面读数如右图所示。
⑨ 经计算,此水样中氧(O2)的含量为(单位:mg·L-1) 。
⑩ 本实验中所加NaOH溶液和H2SO4溶液中m和n应有一定量的关系,即应加适量的H2SO4使溶液呈 (填“酸性”、“碱性”或“接近中性”),其原因是 。
23.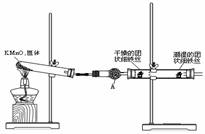 (14分)铁生锈是比较常见的现象,某实验小组,为研究铁生锈的条件,设计了以下快速、易行的方法:
(14分)铁生锈是比较常见的现象,某实验小组,为研究铁生锈的条件,设计了以下快速、易行的方法:
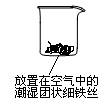
首先检查制氧气装置的气密性,然后按图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②直形管中干燥的铁丝表面依然光亮,没有发生锈蚀;③中潮湿的铁丝依然光亮。
试回答以下问题:
(1)由于与接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于______________。能表示其原理的反应方程式为__________________________________________________。
(2)仪器A的名称为__________,其中装的药品可以是__________,其作用是_________。
(3)由实验可知,该类铁生锈的条件为__________________________________________。
决定铁生锈快慢的一个重要因素是______________________________________________。
22.(8分)“碘钟”实验中,3I-+ S2O32- = I3-+SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到数据如下表:
实验编号 ① ② ③ ④ ⑤
c(I-)/mol•L-1 0.040 0.080 0.080 0.160 0.120
c(S2O32-)/mol•L-1 0.040 0.040 0.080 0.120 0.040
t/s 88.0 44.0 22.0 44.0 t1
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t1=
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)。
A.<22s B.22-44s C.>44s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
21.(10分)某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是____________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水 从_________口进入。蒸馏时要加入生石灰,目的是_____________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( )
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com