
题目列表(包括答案和解析)
12.当电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是
A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成
B.电池的正极反应式为:O2 + 2H2O + 4e- = 4OH-
C.电解后c(Na2CO3)不变,且溶液中有晶体析出
D.电池中c(KOH)不变;电池中溶液pH变大
11、通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)︰n(硝酸亚汞)=2︰1,则下列表述正确的是
A.在两个阴极上得到的银和汞的物质的量之比n(银)︰n(汞)=2︰1
B.在两个阳极上得到的产物的物质的量不相等
C.硝酸亚汞的化学式为HgNO3 D. 硝酸亚汞的化学式为Hg2(NO3)2
9.下图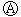 为直流电源,
为直流电源,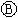 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现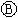 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通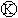 后,使c、d两点短路.下列叙述正确的是
后,使c、d两点短路.下列叙述正确的是
A.a为直流电源的负极 B.c极发生的反应为2H++2e-=H2↑
C.f电极为锌板 D.e极发生氧化反应
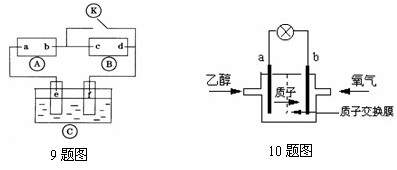
|
200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:
C2H5OH +3O2 =2CO2 +3H2O,电池示意如图,下列说法不正确的是
A.a极为电池的负极 B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ + O2 + 4e- =2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
8、已知反应: ①2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是( )
A.碳的燃烧热大于110.5 kJ/mol B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
7、已知反应X+Y= M+N为放热反应,,对该反应的下列说法中正确的
A、X的能量一定高于M B、Y的能量一定高于N
C、X和Y的总能量一定高于M和N的总能量
D、因该反应为放热反应,故不必加热就可发生
6、家用炒菜铁锅用水清洗放置后出现红棕色的锈斑,在此变化过程中不发生的化学反应是
A、4Fe(OH)2+2H2O+O2=4Fe(OH)3↓ B、2Fe+2H2O+O2=2Fe(OH)2↓
C、2H2O+O2+4e―=4OH- D、Fe-3e―=Fe3+
5、有甲、乙、丙、丁四种金属。将甲、乙用导线相连放入稀H2SO4中可以看到乙慢慢地溶解,而甲的表面有气体逸出。把丁放到乙的硝酸盐溶液中后,丁的表面覆盖一层乙的单质。用石墨电极电解含相同物质的量浓度的甲和丙两种金属的盐溶液,丙的单质先析出。将甲放入稀盐酸中有H2析出。已知四种金属中有一种是铜。根据以上实验判断铜是( )
A、甲 B、乙 C、丙 D、丁
4、在25℃时,将两个铂电极插入一定量的饱和Na2SO4溶液中进行电解,通电一段时间后在阳极逸出a摩气体,同时析出w克Na2SO4·10H2O晶体,若温度不变,此时剩余溶液的质量分数是 ( )
A
 ×100% B
×100% B
 ×100%
×100%
C 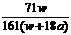 ×100% D
×100% D 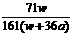 ×100%
×100%
3、下列说法或表示方法中正确的是
A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B、由C(金刚石)→C(石墨);ΔH=+119KJ/mol 可知,石墨比金刚石稳定
C、在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8KJ/mol
D、稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH=-53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ/mol
2、为应对石油危机,2006年1月1日,我省“苏北五市”决定全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油。下列有关说法正确的是
A、乙醇汽油是一种清洁能源,燃烧不会产生污染
B、乙醇与汽油组成元素相同,化学成分相似
C、乙醇汽油燃烧时,耗氧量高于等质量的汽油
D、乙醇可通过淀粉转化制得,是一种可再生的燃料
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com