
题目列表(包括答案和解析)
16.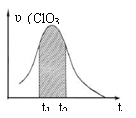 KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。右图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法正确的
KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。右图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法正确的
A.反应开始时速率增大可能是c(H+)所致
B.纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合
C.后期速率υ下降的主要原因是反应向逆反应方向进行
D.图中阴影“面积”可以表示t1-t2时间内c(Cl-)增加量
15、 下图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是
下图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是
A.2SO2 (g)+O2 (g) 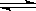 2SO3 (g) ;△H<0
2SO3 (g) ;△H<0
B.4NH3 (g)+O2 (g) 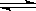 4NO(g)+6H2O (g) ;△H<0
4NO(g)+6H2O (g) ;△H<0
C.H2 (g)+I2 (g)
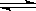 2HI (g) ;△H>0
2HI (g) ;△H>0
D.C (s)+H2O (g) 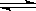 CO (g)+H2 (g) ;△H>0
CO (g)+H2 (g) ;△H>0
14、可逆反应A+B(s) C达到平衡后,无论加压或降温。B的转化率都增大,则下列结论正确的是气体
C达到平衡后,无论加压或降温。B的转化率都增大,则下列结论正确的是气体
A. A为固体C为气体,正反应为放热反应 B. A为气体C为固体,正反应为放热反应
C. A为气体C为固体,正反应为吸热反应 D. A、C均为气体,正反应为吸热反应
13、如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。

其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
C.若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间相同
D.平衡时Ⅰ容器的体积小于V L
12、某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
根据以上规律判断,上列结论正确的是
A 反应Ⅰ:△H>0,P2>P1 B 反应Ⅱ:△H<0,T1>T2
C 反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 D 反应Ⅳ:△H<0,T2>T1
11、在容积固定的密闭容器中存在如下反应: A(g) + B(g) 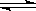 3 C(g); (正反应为放热反应)某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
3 C(g); (正反应为放热反应)某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
下列判断一定错误的是
A、图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B、图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C、图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D、图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较低
10、对于平衡体系:aA(g)+bB(g)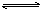 cC(g)+dD(g);正反应放热,有下列判断,其中正确的是:
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是:
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于c+d
B.若从正反应开始,平衡时,A、B的转化率相等,则A、B的物质的量之比为a:b
C.若平衡体系中共有气体M mol,再向其中充入bmolB,达到平衡时气体总物质的量为M+bmol,则a+b=c+d
D.若a+b=c+d ,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变。
9、下列事实不能用勒夏特列原理解释的是
A.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
B.黄绿色的氯水光照后颜色变浅
C.使用催化剂可加快SO2转化为SO3的速率
D.在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
8、可用右侧示意图象表示的是
7、甲、乙两容器都发生反应 2A(g)+ B(g )  xC(g),两容器温度和初始压强都相同。甲容器中充入 2 molA 和 1 molB,达平衡后,C 在平衡混合气中的体积分数为φ、物质的量为 n1;乙容器中充入 1.4
molA,0.7 molB 和 0.6 molC,达平衡后 C 在平衡混合气中的体积分数为φ、物质的量为 n2。下列说法中正确的是
xC(g),两容器温度和初始压强都相同。甲容器中充入 2 molA 和 1 molB,达平衡后,C 在平衡混合气中的体积分数为φ、物质的量为 n1;乙容器中充入 1.4
molA,0.7 molB 和 0.6 molC,达平衡后 C 在平衡混合气中的体积分数为φ、物质的量为 n2。下列说法中正确的是
A.若甲、乙两容器均为恒容容器,则 x必等于 2
B.若甲、乙两容器均为恒压容器,则 x必等于 3
C.若甲为恒压容器、乙为恒容容器,且 x≠3,则 n1必大于 n2
D.若甲为恒容容器、乙为恒压容器,且 x= 3,则 n1必大于 n2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com