
题目列表(包括答案和解析)
22.氮化硅是一种新型陶瓷材料,它
可由石英与焦炭在高温的氮气流中,
通过以下反应制得:
□SiO2+□C+□N2 □Si3N4+□CO
□Si3N4+□CO
(1) 配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应中的氧化剂是__________,其还原产物是_____________。
(3)该反应的平衡常数表达式为K =_______________________;
(4)将知上述反应为放热反应,则其反应热DH________零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值________(填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向_______反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v (CO) =18 mol/(L·min),则N2消耗速率为v (N2) =__________mol/(L·min)。
21.如右图已知:
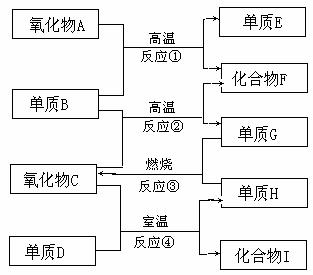 ①单质E可作为半导体材料;
①单质E可作为半导体材料;
②化合物F是不能生成盐的氧化物;
③化合物I能溶于水呈酸性,它能
够与化合物A反应。据此,请填空:
(1)化合物F的化学式为 。
(2)化合物I的名称是 。
(3)反应③的化学方程式为
。
(4)反应④的化学方程式为
。
19.北京市场销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
20-50 mg/kg |
|
分装日期 |
|
|
分装企业 |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
___KIO3+___KI+___H2SO4 =___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是
________________________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及上述步骤中的位置是________________________________。
(3)已知:I2+2S2O32 - = 2I-+S4O62 -。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是______________________________________。
②b中反应所产生的I2的物质的量是________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)________________mg/kg。
|
18.在100mL含有等物质的量的HBr和H2SO3的溶液中通入0.01mol Cl2,有2/3的Br –转变为Br2(已知Br2能氧化H2SO3)。则原溶液中HBr和H2SO3的物质的量浓度为( )
A.0.0075 mol·L-1 B.0.075 mol·L-1
C.0.008 mol·L-1 D.0.08 mol·L-1
17.下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.1.0 mol·L-1Na2CO3溶液:c(OH-) = c(HCO3-) + c(H+) + 2c(H2CO3)
B.1.0 mol·L-1 NH4Cl溶液:c(NH4+) = c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-)
16.将2 mol A和1 mol B充入某密闭容器中发生反应:
2A (g)+B (g) xC(g),达到化学平衡后,C的体积分数为a。假设该反应的条件分别和下列各选项的条件相同,下列判断不正确的是 (
)
xC(g),达到化学平衡后,C的体积分数为a。假设该反应的条件分别和下列各选项的条件相同,下列判断不正确的是 (
)
A.若在恒温恒压下,当x=1时,按1.5 mol A、1 mol C作为起始物质,达到平衡后,C的体积分数仍为a
B.若在恒温恒容下,当x=2时,将2molC作起始物质,达到平衡后,C的体积分数仍为
a
C.若在恒温恒压下,当x=3时,1 mol A、1mol B、6mol C作起始物质,达到平衡后,C的体积分数仍为a
D.若在恒温恒容下,按0.6mol A、0.3mol B、1.4mol C作起始物质,达到平衡后,C的体积分数仍为a,则x为2或3
15.在100mL 0.10mol·L-1的AgNO3溶液中加入100mL溶有2.08g BaCl2的溶液,再加入100 mL 溶有0.010mol CuSO4的溶液,充分反应。下列说法中正确的是 ( )
A.最终得到白色沉淀和无色溶液
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物
C.再最终得到的溶液中,Cl-的物质的量为0.02mol
D.再最终得到的溶液中,Cu2+的物质的量浓度为0.01mol·-1
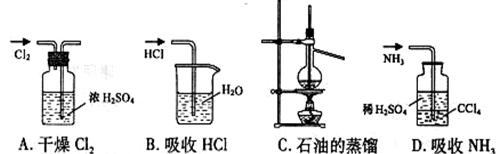
14.用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是 ( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com