
题目列表(包括答案和解析)
6.下列物质中,既有共价键又有分子间作用力的是 ( )
A.氧化镁 B.氦 C.铜 D.液氨
5.合金钢Q460是支撑“鸟巢”的铁骨钢筋,除含有铁元素外,还含有Mn(锰)、Ti(钛)、Cr(铬)、Nb(铌)等合金元素。下列有关说法正确的是 ( )
A.工业上利用热还原法冶炼金属Fe、Cr、Mn
B.Fe位于元素周期表的第四周期、第ⅧB族
C.46 22TiO2、48 22 TiO2、50 22 TiO2互为同位素
D.92 41Nb3+原子核内有51个中子,核外有41个电子
4.有关天然物质水解叙述不正确的是 ( )
A.蛋白质水解的最终产物均为氨基酸
B.可用碘水检验淀粉是否水解完全
C.变质的油脂有难闻的气味,是由于油脂发生了水解反应
D.纤维素水解和淀粉水解得到的最终产物相同
3.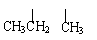 对于烃CH3-CH2-CH2-CH-CH-CH3的命名正确的是 ( )
对于烃CH3-CH2-CH2-CH-CH-CH3的命名正确的是 ( )
A.2-甲基-3-丙基戊烷 B.3-异丙基己烷
C.2-甲基-3-乙基己烷 D.5-甲基-4-乙基己烷
2.有一只50mL酸式滴定管,其中盛有溶液,液面恰好在10.00mL刻度处,把滴定管中的溶液全部流下排出,承接在量筒中,量筒内溶液的体积 ( )
A.大于40.0 mL B.为40.0 mL
C.大于10.0 mL D.为10.0mL
1.下列各项中表达不正确的是 ( )
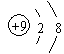
A.F-的结构示意图:

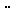
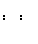
B.NaCl的电子式:Na Cl
C.CO2分子的结构式:O=C=O
D.碳-12原子:12 6C
26.Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1 :2。D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是 ;
(2)从B分子的立体结构判断,该分子属于 分子(填“极性”或“非极性”);
(3)C分子中都包含_______个σ键,_______个π键。
(4)D的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明D是何物质):
_____________________________________________________________________。
II.CO的结构可表示为C≡O,N2的结构可表示为N≡N。
(5)下表是两者的键能数据:(单位:kJ/mol)
|
|
A-B |
A=B |
A≡B |
|
CO |
357.7 |
798.9 |
1071.9 |
|
N2 |
154.8 |
418.4 |
941.7 |
结合数据说明CO比N2活泼的原因:
___________________________________________________。
Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
(6)基态Ni原子的核外电子排布式为 __ ____ ,基态Cu原子的价电子排布式为___________________________。
(7)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ___________ (填晶体类型)。
25.Ⅰ.有机物A的质谱图和红外光谱图分别如下:
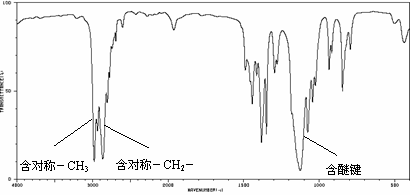
(1)A的结构简式为:___________________________________。
Ⅱ.相对分子质量不超过100的有机物B, 既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。 B完全燃烧只生成CO2和H2O。经分析其含氧元素的质量分数为37.21%。经核磁共振检测发现B的氢谱如下:
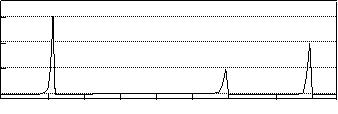
(2)B的结构简式为:___________________________________。
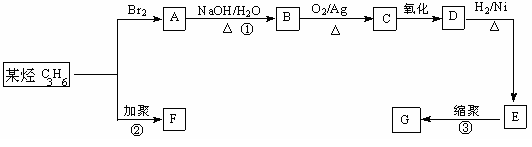 Ⅲ.塑料是常用的合成高分子材料,常用塑料F、G均可由某烃经下列反应得到:
Ⅲ.塑料是常用的合成高分子材料,常用塑料F、G均可由某烃经下列反应得到:
(3)写出反应①的化学方程式:_________ _________________________;
(4)写出反应②的化学方程式:_________ _________________________;
(5)写出反应③的化学方程式:_________ _________________________;
24.在下图所示的转化关系中,括号内编号①-④表示转化所需化学试剂:

(1)用化学式填空:
①是 、②是 、
③是 、④是 、
(2)A的结构简式是 。
(3)反应④的化学方程式为 。
23.碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:
6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2
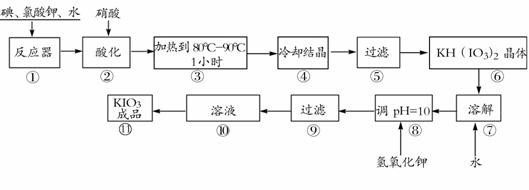
(1)步骤①反应器发生的反应中,转移电子总数为 ;
(2)步骤②中,用硝酸而不用HI,其原因可能是 ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的操作方法是 。
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com