
题目列表(包括答案和解析)
18.(10分)W、X、Y、Z是原子序数依次增大的同-短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式
为__________________________________________________;
(2)W与Y可形成化合物W2Y,该化合物的电子式为__________________________;
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_____________:
(4)比较Y、Z气态氢化物的稳定性:____________>___________(用分子式表示);
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:
______________>_____________>______________>_____________;
(6)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,
并放出QkJ的热量。写出该反应的热化学方程式:_______________________。
17.(9分)请回答下列化工知知识.
(1)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。硫化氢与FeCl3溶液 反应生成单质硫,其离子方程式为 ________________________________;如果用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总反应方程式(忽略氧的氧化还原)为 ________________________________,该方法的优点是______________________________________________________;
(2)电解饱和食盐水常用离子膜电解槽和隔膜电解槽。阳离子膜和隔膜均允许通过的
分子或离子是______________,电解槽中的阳极材料为 ____________________;
(3)第ⅢA、VA元素组成的化合物GaN、GaP、CaAs等是人工合成的新型半导体材料,
其晶体结构与单晶硅相似。在GaN晶体中,每个Ga原子与____________个N原
子相连,与同一个Ga原子相连的N原子构成的空间构型为_____________。
16.(10分)某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
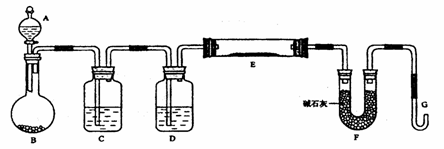
请回答下列问题:
(1)仪器中装入的试剂:C__________、D__________;
(2)连接好装置后应首先___________,其方法是__________:
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是_________,
在这两步之间还应进行的操作 ________________________;
(4)从实验中测得了下列数据
①空E管的质量a ②E管和WO3的总质量b
③反应后E管和W粉的总质量c (冷却到室温称量)
④反应前F管及内盛物的总质量d ⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉
及的元素的相对原子质量均为已知):
计算式1:Ar(W)=____________:计算式2:Ar(W)=___________。
15.下列说法中正确的是( )
A.离子晶体中每个离子周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外电场作用下金属产生自由电子,电子定向移动
C.分子晶体的熔沸点很低,常温下都呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合
第Ⅱ卷(非选择题,共55分)
14.X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是( )
A.由mXa+与nYb-,得m+a=n-b
B.X2-的还原性一定大于Y-
C.X、Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
13.下列各组物质的无色溶液,不用其它试剂即可鉴别的是( )
①KOH Na2SO4 AlCl3 ②NaHCO3 Ba(OH) 2 H2SO4
③HCI NaAlO2 NaHSO4 ④Ca(OH) 2 Na2CO3 BaCl2
A.①② B.②③ C.①③④ D.①②④
12.1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A.Na2CO3 B.Na2O2 Na2CO3
C.NaOH Na2CO3 D.Na2O2 NaOH Na2CO3
11.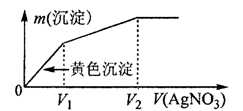 往含I-和C1-的稀溶液中滴入AgNO3溶液,沉淀的质量m(沉淀)与加入AgNO3溶液体积V(AgNO3)的关系如图所示。则原溶液中
往含I-和C1-的稀溶液中滴入AgNO3溶液,沉淀的质量m(沉淀)与加入AgNO3溶液体积V(AgNO3)的关系如图所示。则原溶液中
c(I-)/c(Cl-)的比值为( )
A.(V2-V1)/V1
B.V1/V2
C.V1/(V2-V1)
D.V2/V1
10.下列叙述正确的是( )
A.1个甘氨酸分子中存在9对共用电子
B.PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构
C.H2S和CS2分子都是含极性键的极性分子
D.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅
9.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com