
题目列表(包括答案和解析)
7、进行硫酸铜晶体结晶水含量测定时,下列哪种情况会使实验结果偏高
A、晶体中含有不分解的杂质 B、瓷坩埚在称量前未经干燥处理
C、晶体尚带蓝色即停止加热 D、晶体加热脱水后未放入干燥器中冷却后称量
6、下列各组离子能在指定环境中大量共存的是
A、在C(HCO3-)= 0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3-
B、在由水电离出的C(H+)=1×10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO42-
C、pH=2的溶液中:Na+、Fe3+、NO3-、[Ag(NH3)2]+
D、在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+
5、工业上由二氧化锰制备高锰酸钾可分二步进行,第一步:二氧化锰与氢氧化钾共熔并通入氧气2MnO2 + 4KOH +O2
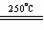 2K2MnO4 +2H2O;第二步:电解锰酸钾溶液:2K2MnO4 +2H2O
2K2MnO4 +2H2O;第二步:电解锰酸钾溶液:2K2MnO4 +2H2O 2KMnO4
+H2↑ +2 KOH 则下列说法正确的是
2KMnO4
+H2↑ +2 KOH 则下列说法正确的是
A、氧化性:KMnO4 >K2MnO4 >O2
B、根据上述过程,每生成1molKMnO4共转移6mol电子
C、第二步电解时,KMnO4在阳极区生成
D、第二步电解时阴极周围pH减小
4、以石灰石、食盐、焦炭、水和空气为主要原料,不能生产的化工产品是
A、玻璃 B、烧碱 C、硝酸铵 D、漂白粉
2、 用Cu(OH)2胶体做电泳实验时,阴极附近蓝色加深,往此胶体中加入下列物质时,不发生聚沉的是 ①硫酸镁溶液 ②硅酸胶体 ③氢氧化铁胶体 ④葡萄糖溶液 A、①② B、③④ C、②③ D、①④ 3、在硫酸的工业制法中,下列生产操作与说明操作的主要原因二者都正确的是
A、硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能燃烧
B、从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应
C、SO2氧化为SO3时需使用催化剂,这样可提高SO2的转化率
D、SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,以使SO3吸收完全
1、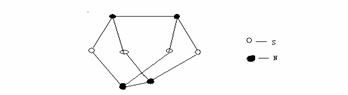 为控制和整治大气污染,科技界开展了大量研究,取得了许多新成果。S-N 化合物在此领域的应用属于先进技术,如图是已经合成的最著名的S-N 化合物的分子结构。下列说法正确的是
为控制和整治大气污染,科技界开展了大量研究,取得了许多新成果。S-N 化合物在此领域的应用属于先进技术,如图是已经合成的最著名的S-N 化合物的分子结构。下列说法正确的是
A、据均摊法可知该物质的分子式为S2N
B、该物质具有很高的熔、沸点
C、该物质的分子中既有极性键又有非极性键
D、该物质与化合物S2N2 互为同素异形体
26.(11分)A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、 Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
① A和E的溶液显碱性,0.1mol/L A溶液的pH小于13;
② 在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③ 在C的溶液中加入铁粉,溶液的质量增加;
④ 在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
(1)根据以上事实推断A-E的化学式:
A 、B 、C 、D 、E
(2)写出②、③、④的离子方程式:
②
③
④
25.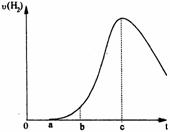 (9分)把在空气中久置的铝片5.0 g投入盛
(9分)把在空气中久置的铝片5.0 g投入盛
有 500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝
片与硫酸反应产生氢气的速率与反应时间可用如右
图的坐标曲线来表示,回答下列问题:
(1)曲线由0→a段不产生氢气的原因
___________________;(用化学方程式表示)
(2)曲线由a→b段产生氢气的速率较慢的原因__________________________;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因_________________;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因__________________。
24.(13分)在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
(1)生成的黑色(单质)物质是 (填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是___________ (填化学式),这种黑色物质继续与浓硫酸作用,产生两种气体的化学方程式为 ____________________
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有 (填序号)。
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(4)将实验②产生的刺激性气味气体通入品红溶液,可以看到品红溶液____________说明这种气体具有_____________________性;将②中产生的刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式________________________________
(5)能否用澄清石灰水鉴别这两种气体? (填“能”或“不能”)若不能请填写两种能鉴别的试剂 。
23.(10分)在一定量的石灰乳中通入一定量
的氯气,二者恰好完全反应(发生的反应
均为放热反应)。生成物中含有Cl-、ClO-、
ClO3-三种含氯元素的离子,其中ClO-、
ClO3-两种离子的物质的量(n)与反应时
间(t)的曲线如右图所示。
(1)t2时,Ca(OH)2与Cl2发生反应的总的化
学方程式为:______________________ 。
(2)该石灰乳中含有Ca(OH)2的物质的量是______ mol。
(3)据分析,生成Ca(ClO3)2的反应是由温度升高引起的,通入Cl2的速度不同,ClO-和ClO3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后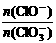 2(填“>”、“<”或“=”);
2(填“>”、“<”或“=”);
若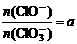 ,则n(Cl-)= mol(用含a的代数式来表示)。
,则n(Cl-)= mol(用含a的代数式来表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com