
题目列表(包括答案和解析)
6. 以下离子方程式正确的是
A. 氧化铁溶于氢碘酸:Fe2O3+6H+ = 2Fe3++3H2O
B. 等物质的量的KHCO3和Ba(OH)2的溶液混合:HCO3-+Ba2++OH- = BaCO3↓+H2O
C. NaHSO3溶液显酸性是因为:HSO3- = SO32-+ H+
D. 硫化钠水溶液呈碱性的原因:S2-+2H2O
 H2S↑+2OH-
H2S↑+2OH-
5. 对下列实验现象的分析,结论正确的是
|
|
编
号 |
实验现象 |
结 论 |
|
A |
甲溶液中加入氯化钡、稀硝酸的混合液 |
产生白色沉淀 |
甲溶液中一定含有SO42-或SO32- |
|
B |
乙溶液进行焰色反应 |
焰色呈黄色 |
乙一定是钠盐溶液 |
|
C |
丙溶液中加入硝酸银、稀硝酸的混合液 |
产生白色沉淀 |
丙溶液中一定有Cl- |
|
D |
把湿润的碘化钾-淀粉试纸放入红棕色丁气体中 |
试纸变蓝色 |
丁不一定是溴蒸气 |
4. 过氧化氢是一种很弱的酸,酸性比碳酸还要弱,为了验证其酸性,请选择一种最合适的盐溶液与其反应
A. 碳酸钠溶液 B.碳酸氢钠溶液 C. 偏铝酸钠溶液 D. 硫化钠溶液
3. 以下人体日常补水的观点中,你认为科学的是
A. 长期饮用碳酸饮料,有利于补充人体CO2
B. 因为自来水都是用氯气、漂白粉或二氧化氯消毒过,所以可直接饮用
C. 最好喝纯净水,因为纯净水不含任何化学物质
D. 运动员大量运动出了很多汗,最好喝含有氯化钠的水,这样可以补充必需的盐分
2. 某地有“天明得晚黑得快,洗脸快不如脸脏得快”一说,这是因为该地从早到晚一直处于红棕色烟雾中,附近居民深受其害。你估计这一空气污染物中可能含有
A. 煤炭粉尘 B. P2O5粉尘 C. SiO2粉尘 D. Fe2O3粉尘
1.下列有关钋(Po)的说法正确的是
A. 钋原子的核外电子数是126 B. 钋原子核内中子数与质子数之差是42
C. 钋是金属元素,最外层电子数小于4 D. 钋元素的相对原子质量是210
22、现用100t含FeS2 90%的黄铁矿石制硫酸,在煅烧时损失硫5%,在接触室里SO2的转化率为92%,在吸收塔里又有0.6%的SO3被损失,请回答:
(1)写出硫铁矿石燃烧的化学方程式 ;
(2)工厂尾气中含有大量SO2。下列处理方案中合理的是 (填代号);
a.高空排放 b.重新用于制硫酸
c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
(3)在理论上有多少吨SO3被完全吸收?若用浓硫酸吸收SO3后全部得到H2SO4·1.5SO3,则至少需要98%的浓硫酸多少吨来充分吸收SO3?
21、(12分)某学习小组用下图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
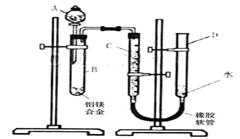 (1)B中发生反应的离子方程式为 。
(1)B中发生反应的离子方程式为 。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是 。然后将其洗涤,干燥,称重。
(3)实验按如下操作的顺序进行,请补充:
①按左图连接好装置。
②检查气密性,具体操作方法为 。
③将药品和水装入各仪器中,连接好装置,记录 C的液面位置;④由A向B中滴加足量试剂;
⑤待B中不再有气体产生并恢复至室温后,记录C的液面位置;记录C的液面位置时,除视线平视外,还应 。
⑥将B中剩余物质过滤,洗涤,干燥,称重。
(4)若实验用去铝镁合金的质量为a g,测得氢气体积为b ml(已换算为标准状况),B中剩余固体的质量为cg,则铝的相对原子质量为 。
(5)实验步骤⑥中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将 。(填“偏大”、“偏小”、“不受影响”) 。
20、(9分)现有NaCl 、Na2SO4 和NaNO3 的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl- 、SO42- 和NO3- 的相互分离。相应的实验过程可用下图表示:
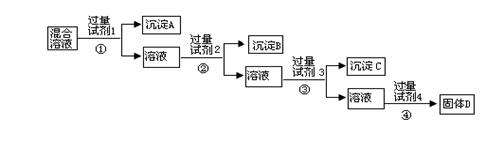 ⑴写出上述实验过程中所用试剂的名称:
⑴写出上述实验过程中所用试剂的名称:
试剂 1 、试剂2 、试剂4 。
⑵恰当地控制试剂4 的加入量的方法是 。
⑶加入过量试剂3的目的是 。
⑷在加入试剂4后,获得固体D 的实验操作④是 (填操作名称)。
19、如下图,溶液①是由A、B两种正盐组成,它与其他物质之间有如下转化关系:
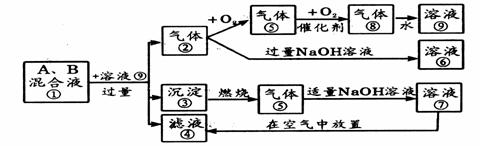 (1)写出下列反应的离子方程式:
(1)写出下列反应的离子方程式:
⑦→④: ②→⑥:
(2)溶液①中溶质可能有多种组合,推出其可能的化学式及物质的量关系。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com