
题目列表(包括答案和解析)
16. 镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
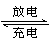 x
Mg+Mo3S4
Mgx Mo3S4
;在镁原电池放电时,下列说法错误的是
x
Mg+Mo3S4
Mgx Mo3S4
;在镁原电池放电时,下列说法错误的是
A.Mg2+向正极迁移 B.正极反应为:Mo3S4+2xe- = Mo3S42x-
C.Mo3S4发生氧化反应 D.负极反应为:xMg - 2xe- = xMg2+
15. 关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛其化学机理为:

 ①HUr + H2O Ur- + H3O+ ②Ur-(aq)+Na+(aq) NaUr(s)
①HUr + H2O Ur- + H3O+ ②Ur-(aq)+Na+(aq) NaUr(s)
尿酸 尿酸根离子
下列对反应②叙述中正确的是( )
A.反应的△H>0 B.反应的△H<0
C.升高温度平衡向正反应方向移动 D.降低温度平衡向正反应方向移动
14. 如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。

其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
C.若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间相同
D.平衡时Ⅰ容器的体积小于V L
13. 某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:

方案I:铜铝混合物 测定生成气体的体积

方案II:铜铝混合物 测定剩余固体的质量
下列有关判断中不正确的是
A. 溶液A和B均可以是盐酸或NaOH溶液 B. 溶液A和B均可以选用稀硝酸
C. 若溶液B选用浓硝酸,则测得铜的质量分数偏小
D. 实验室方案II更便于实施
12. 生物体中细胞膜内的葡萄糖与细胞膜外富氧液体及细胞膜构成微型的生物原电池。下列有关电极反应及产物的判断正确的是:
A.负极反应可能是O2+2H2O+4e- =4OH-
B.负极反应的产物主要是C6H12O6 被氧化生成的CO32-、HCO3-、H2O
C.正极反应可能是6C6H12O6-24e- + 24OH-==6CO2+18H2O
D.正极反应的产物主要是C6H12O6生成的CO2、CO32-、H2O
11. 下列离子方程式书写正确的是
A.铁跟盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.碳酸氢钙溶液跟过量氢氧化钠溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O
C.次氯酸钙溶液中通入过量的CO2:ClO-+H2O+CO2=HCO3-+HClO
D.氯化铝溶液与过量的氨水反应:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
10. 设阿伏加德常数为NA,则下列说法正确的是
A.7.8gNa2O2与足量水反应时,转移的电子数为0.2NA
B.25℃、1.01×105Pa条件下,11.2L丙炔分子中所含碳氢键数为2NA
C.常温下,2.7g铝分别与足量的盐酸或烧碱溶液反应时,失去的电子数都为0.3NA
D.常温下,1L0.1mol·L-1CH3COOH溶液中含CH3COO-数为0.1NA
9. “化学反应的绿色化”要求原料物质中所有的原子被安全利用且全部转入期望的产品中。下列符合“化学反应的绿色化”的是
|
 B. 2C2H5OH
+ O2 2CH3CHO
+ 2H2O
B. 2C2H5OH
+ O2 2CH3CHO
+ 2H2O
C. 2M+N = 2P+2Q,2P+M = Q(M、N为原料,Q为期望产品)
D. 用Fe屑、CuO、稀硫酸为原料制铜:CuO+H2SO4=CuSO4+H2O,Fe+CuSO4=FeSO4+Cu
8. ①pH=0的盐酸 ②0.5mol·L-1盐酸 ③0.1mol·L-1的NH4Cl溶液 ④0.1mol·L-1的NaOH溶液 ⑤0.5mol·L-1的NH4Cl溶液,以上溶液中水电离的c(H+)由大到小的顺序是
A. ⑤③④②① B. ①②③⑤④ C. ①②③④⑤ D. ⑤③④①②
7. 打火机给人们生活带来方便,右图是普通
电子打火机的实物照片。下面可以做到符合
 燃烧条件能打火的组合是
燃烧条件能打火的组合是
A. ①③⑤ B. ①③④
C. ①②③ D. ①②④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com