
题目列表(包括答案和解析)
26.(10分)2005年11月13日,吉林石化公司双苯厂发生的爆炸事件,使大量的苯胺及其生产原料(苯、硝基苯等)进入松花江,造成松花江水体被严重污染。
(1)下列有关叙述正确的是 (填序号)。
A.进入水体的苯会溶于水,造成鱼类大量中毒死亡
B.进入水体的硝基苯会浮在水面上迅速流向下游
C.工业上用硝基苯制取苯胺是氧化反应
D.苯和硝基苯的混合物可通过蒸馏的方法将其分离
(2)自来水厂对上述受污染的江水进行净化处理,采用的经济有效的方法是 (填序号)。
A.分液 B.过滤 C.用活性炭吸附有毒物质 D.加热蒸发
 (3)磺胺类药物,常用于肠道抗菌感染的治疗,工业上可用苯为原料通过下列反应制得磺胺。(转化关系中-H2O、-HCl、-CH3COOH分别表示反应中有H2O、HCl、CH3COOH生成)
(3)磺胺类药物,常用于肠道抗菌感染的治疗,工业上可用苯为原料通过下列反应制得磺胺。(转化关系中-H2O、-HCl、-CH3COOH分别表示反应中有H2O、HCl、CH3COOH生成)
①反应Ⅰ的反应类型是 反应。
②分析上述反应过程中所提供的有关信息,写出C的结构简式: 。
③写出D → E的化学方程式:
。
25. (10分)(Ⅰ)(3分)下图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”。
(10分)(Ⅰ)(3分)下图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”。
(1)doggycene的分子式为________________。
(2)1mol该物质在氧气中完全燃烧生成CO2和水的物质的量
之比为______。
(3)该分子中所有碳原子__________(填“可能”或“不可能”)处于同一平面。
(Ⅱ)(7分)分子式为C13H16O2的惕各酸苯乙酯广泛用于香精的调香剂。已知:
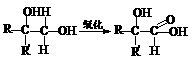
。 为了合成惕各酸苯乙酯,某实验室的科技人员设计了下列合成路线:
|
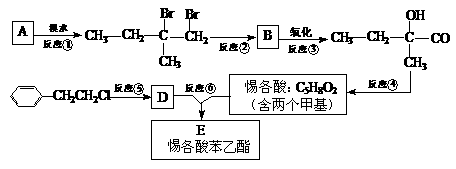
试回答下列问题:
(1)用系统命名法命名A的名称为_____________;B的结构简式为_______________。
(2)反应②中另加的试剂是_______________;在惕各酸同分异构体中,含“C=C”甲酸的酯共有_______种。
(3)试写出反应⑥的化学方程式:______________ __________________。
(4)上述合成路线中属于消去反应的是 (填编号)。
24.(13分)实验室可以用下图所示仪器连接起来制备纯净的二氧化碳并测定其式量。
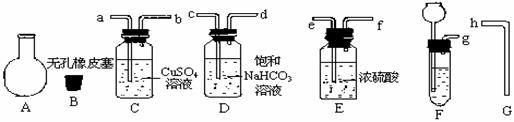
现用含有少量硫化亚铁的大理石和盐酸反应制备二氧化碳气体, 实验步骤如下:
(1)将橡皮塞B塞在A烧瓶口, 并用橡皮筋套在烧瓶的瓶颈处以标记橡皮塞所塞入瓶颈的深度, 准确称其质量为m1g。
(2)连接制备和净化气体的装置, 其接口连接顺序是: 接 , 接 , 接 , 接 。
(3)将导管G插入烧瓶A中用向 (填“上”或“下”)排空气法收集二氧化碳气体; 检验二氧化碳气体已经充满烧瓶的方法是
若经检验, 二氧化碳气体已经充满烧瓶, 迅速用橡皮塞塞好烧瓶, 并称其质量为m2g。
(4)将烧瓶口橡皮塞取下, 向烧瓶内注水至标记线, 再将水小心地倒入量筒, 测量出水的体积为V1mL; 将该体积换算成标准状况时的体积为V2mL。
请写出二氧化碳式量的计算式 。
若不将气体净化和干燥, 所测定的二氧化碳式量的数值将会 (填“偏高”或“偏低”), 其理由是 。
23.(11分) 在密闭容器中进行如下反应: ,反应经5分钟达到平衡,测得此时A的浓度减小了a mol/L,而C的浓度增加了
,反应经5分钟达到平衡,测得此时A的浓度减小了a mol/L,而C的浓度增加了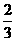 a mol/L,又知平均反应速率:v (C) =2v (B)。
a mol/L,又知平均反应速率:v (C) =2v (B)。
(1)写出上述化学方程式中各物质的系数:m = _______,n = ________,p = ________。
(2)压强一定时,C的百分含量与温度、时间(T表示温度,t表示时间)的关系如右图所示。
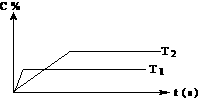
由此可知,该反应为__________________(填“吸热”或“放热”)反应。
(3)该反应的平衡常数表示式为______________________________;升高温度,K值将________________(填“增大”、“减小”或“不变”)。
(4)以下图1、图2均表示该反应在t1时达到平衡,在t2时改变某条件发生变化的曲线。

试判断,图1中t2时改变的条件是______________________________;图2中t2时改变的条件是______________________________。
22.(10分)(1)为了防止枪支生锈,常将制成的枪支进行“发蓝”处理,也就是将枪支入放入NaNO2和NaOH的混合溶液中迅速氧化,表面生成Fe3O4的细密的保护层,主要反应是:a:3Fe+ NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
b:6 Na2FeO2+ NaNO2+5H2O=3Na2Fe2O4+H2O+NH3↑+7NaOH
c: Na2FeO2+ Na2Fe2O4+ H2O = Fe3O4+ NaOH
①请填入上面第3个方程式(c)中的各物质的系数。
②温度升高,发蓝层会增厚,原因是 ;
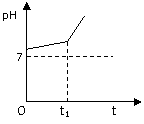 (2)用惰性电极电解NaCl与NaHCO3混合溶液,测得溶液pH变化如下图所示。
(2)用惰性电极电解NaCl与NaHCO3混合溶液,测得溶液pH变化如下图所示。
① 在0→t1时间内,两个电极上的电极反应式为:
阳极 ;
阴极 。
②用离子方程式表明0→t1时间内,溶液pH升高比较缓慢的原因: 。
21. (12分)某同学利用废铁屑(含有Cu等与盐酸不反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有mg铁粉,烧杯中放有过量的稀硝酸。实验时,打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,充分反应后溶液为浅绿色,再打开b进行过滤;过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体,填写下列空白:
(12分)某同学利用废铁屑(含有Cu等与盐酸不反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,A中放有mg铁粉,烧杯中放有过量的稀硝酸。实验时,打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,充分反应后溶液为浅绿色,再打开b进行过滤;过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余HNO3分解,再降温结晶得FeCl3·6H2O晶体,填写下列空白:
(1)如何检查装置的气密性:
。
(2)滴加盐酸时发现反应速率较之同浓度盐酸与铁反应要快原因是
(3)将烧杯内的溶液用蒸发、浓缩、再降温结晶法得到FeCl3·6H2O晶体,不采用直接蒸发结晶的方法制得晶体的理由是
。
(4)有该法制得的晶体中往往混有Fe(NO3)3,为了制得纯净的FeCl3•6H2O晶体,可将烧杯内的稀硝酸换成
。
(5)若测定废铁屑的纯度,可测出从B中放出气体的体积V(已折算成标准状况,单位:L),则废铁屑的纯度为 (用含m、V的代数式表示)。请在框图c中画出必要的装置。
20.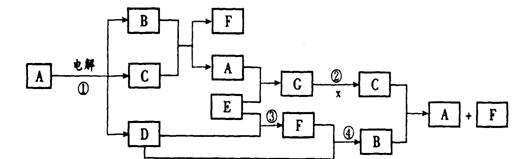 (8分)下图是一些常见物质间的转化关系图,图中所有物质含有的元素中只有一种不是短周期元素,所有反应物、生成物及溶液中的水均未标出,反应②中还有3种产物未标出,x是室内装潢材料中产生的主要有害气体之一,G是由四种元素组成的强碱。
(8分)下图是一些常见物质间的转化关系图,图中所有物质含有的元素中只有一种不是短周期元素,所有反应物、生成物及溶液中的水均未标出,反应②中还有3种产物未标出,x是室内装潢材料中产生的主要有害气体之一,G是由四种元素组成的强碱。
回答下列问题:
(1)写出下列物质的化学式:B 、C ;
(2)列举两种能氧化x的物质(单质、化合物各一种) 、 ;
(3)写出反应①②的离子方程式:
①
② 。
19、(13分)间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,Cu2+与I-作用可生成I2,I2溶于过量的KI溶液中:I2+I-=I3-,又知氧化性:Fe3+>Cu2+>I2>FeF63-;析出I2可用c mol/LNa2S2O3标准溶液滴定,其反应为:
2S2O32-+I3-=S4O62-+3I-。
操作:准确称取ag胆矾试样(可能含少量Fe2(SO4)3),置于250 mL碘量瓶(带磨口塞的锥形瓶)中,加50 mL蒸馏水、5 mL 3 mol/LH2SO4溶液、少量NaF,再加入足量的10% KI溶液,摇匀。盖上碘量瓶瓶盖,置于暗处5 min,充分反应后,加入指示剂,用Na2S2O3标准溶液滴定至终点,共用去V mL标准溶液。回答下列问题:
⑴实验中,加KI前需加入少量NaF,其作用可能是
;
加3mol/LH2SO4溶液的作用可能是 。
⑵滴定实验中所用指示剂是 ;滴定终点的判断方法为
。
⑶本实验中用碘量瓶而不用普通锥形瓶是因为:
。
⑷硫酸铜与碘化钾反应后,Cu2+被还原成白色的碘化亚铜沉淀,该反应的离子方程式为:
。
⑸根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)= 。
18.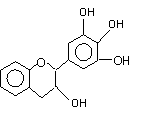 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如下图所示。关于EGC的下列叙述中正确的是 ( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如下图所示。关于EGC的下列叙述中正确的是 ( )
A.分子中所有的原子共面
B.1molEGC与4molNaOH恰好完全反应
C.易发生氧化反应和取代反应,难发生加成反应
D.遇FeCl3溶液发生显色反应
第二卷 非选择题 (共87分)
17. 下列混合溶液中,各离子浓度的大小顺序正确的是
A.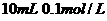 氨水与
氨水与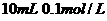 盐酸混合,
盐酸混合,

B.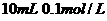
 溶液与
溶液与
 溶液混合,
溶液混合,

C.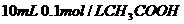 溶液与
溶液与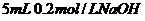 溶液混合,
溶液混合,
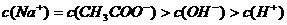
D.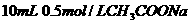 溶液与
溶液与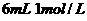 盐酸混合,
盐酸混合,

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com