
题目列表(包括答案和解析)
26、(本题8分)
(1)漏斗、烧杯(2分);
(2)除去溶液中混有的铁;(2分)
(3)静置,取少量上层清液于小试管中,滴入稀硫酸,如果有白色沉淀生成,说明沉淀不完全,如果无明显现象则沉淀完全(2分);
(4)通入过量的二氧化碳气体(2分)。
25、(本题13分)
(1) 白(1分) 红褐(1分) 4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分)
(2) NO(2分) 3NO2+H2O=2HNO3+NO (2分)
(3)烟(1分) 黄绿色(1分) 无色(1分) 5(2分)
24、(本题9分)
(1) Mg(OH)2、Fe(OH)3、CaCO3。 (2分,漏1-2个,扣1分)
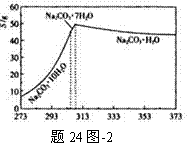
(2) “趁热过滤”的原因是使析出的晶体为Na2CO3·H2O,防止因温度过低而析出Na2CO3·10H2O晶体,令后续的加热脱水耗时长。 (2分)
(3) 连续两次称量的质量差不超过0.1g。 (2分)
(4)Na2CO3·H2O(s)=Na2CO3(s)+H2O(g);ΔH2= +58.73kJ·mol-1
(热化学方程规范2分,反应热数值1分,共3分)
23、(本题11分)
(1)Cu (1分) FeSO4 (1分) Fe(OH)3 (1分)
(2)Cu+H2O2+H2SO4=CuSO4+2H2O (2分,未配平的扣1分)
(3)4Fe2++O2+4H+=4Fe3++2H2O (2分,未配平的扣1分)
2Fe3++2I-=2Fe2++I2 (2分,未配平的扣1分)
(4)2Fe(OH)3+10KOH+3Cl2=2K2FeO4+6KCl+8H2O (2分,未配平的扣1分)
22、(本题6分,每空2分)
(1)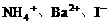 (2分,漏一个,扣1分,多选不给分)
(2分,漏一个,扣1分,多选不给分)
(2)
(2分,漏1-2个,扣1分,多选不给分)
(3)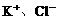 (2分,漏一个,扣1分,多选不给分)
(2分,漏一个,扣1分,多选不给分)
21、(本题6分,每空2分)
(1)①>②>③(2分)
(2)①>②>③(2分)
(3)①=②>③ 或 ①=②=2③ (2分)
27、某中学研究性学习小组的同学对牛奶中的蛋白质进行分析实验:取30mL牛奶(密度为1.03g·cm-3),用盖尔达法分解蛋白质,把样品中的氮完全转化为氨,用0.50mol/LH2SO4溶液50.0mL吸收后,剩余的酸用38.0mL1.00mol/LNaOH溶液中和。
|
|
|
|
求:(1)30mL牛奶中含有多少克氮?
(2)如果蛋白质中氮元素的质量分数为16.8%,则牛奶中含蛋白质的质量分数为多少?
(3)现行奶粉中蛋白质含量的检测主要采用了上述方法,试通过简单计算分析最近的三鹿婴幼儿奶粉受污染事件中,向奶粉中掺入三聚氰胺(C3H6N6)的原因.
参考评分标准
26、(本题8分)某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向溶液中滴加稀硫酸至溶液pH=8-9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、 、 等玻璃仪器。
(2)步骤1过滤的目的是 。
(3)当步骤2中溶液的pH=8-9时,检验沉淀是否完全的方法是:
。
(4)步骤2中溶液的pH较难控制,可改用 。
25、(本题13分)如图(题24图)所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表(题24表)所列的不同实验(气体在同温同压下测定)。试回答下列问题:
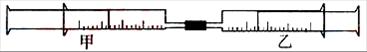
题25图
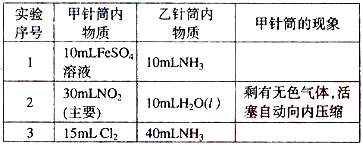
题25表
(1)实验1中,甲针筒的现象:产生 色沉淀,沉淀最终变为________色,写出沉淀变色的化学方程式______________________。
(2)实验2中,甲中的3mL气体是NO2和N2O4(无色气体)的混合气体,那么甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式为
______________________。
(3)实验3中,已知:3Cl2+2NH3 N2+6HCl。甲针筒的现象:甲针筒除活塞有移动,针筒内有白 产生外(填“烟”或“雾”),气体的颜色由__ ___变为__ __。最后针筒内剩余气体的体积约为________mL。
N2+6HCl。甲针筒的现象:甲针筒除活塞有移动,针筒内有白 产生外(填“烟”或“雾”),气体的颜色由__ ___变为__ __。最后针筒内剩余气体的体积约为________mL。
24、 (本题9分)碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO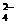 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:
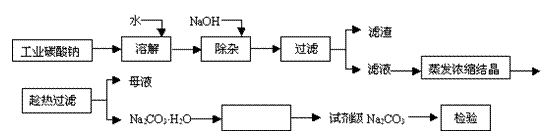
 题24图-1
题24图-1
已知碳酸钠的溶解度(S)随温度变化的曲线如图(题24图-2)所示:
回答下列问题:
(1)滤渣的主要成分为_________________________。
(2)“趁热过滤”的原因是______________________
。
(3)在实验室做Na2CO3·H2O脱水实验,判断其脱水完全的方法是:
____________________ _。
(4)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g);ΔH1= +532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g);ΔH2= +473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式_________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com