
题目列表(包括答案和解析)
28.以石油裂解得到的乙烯和1,3–丁二烯为原料,经过下列反应可合成高分子化合物M,它可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。
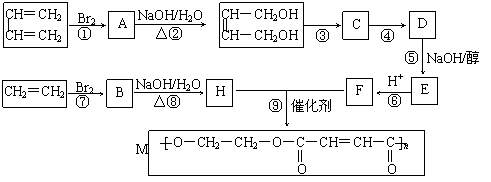
请按要求填空:
(1)写出下列物质的结构简式:F________________;H______________。
(2)写出①、⑧三步的化学方程式,并注明反应类型:
①___________________________________________,反应类型___________;
⑧_________________________________________,反应类型___________。
(3)反应③、④中有一步是与HCl的催化加成,根据合成线索分析,该反应是其中的哪一步?____________(填反应的数字编号),设计这一步的目的是_______(填选项字母)。
A.促进B分子中羟基的氧化 B.促进B分子中碳碳双键的氧化
C.保护B分子中的羟基不被氧化 D.保护B分子中的碳碳双键不被氧化
27.写出符合下列要求的有机物的结构简式:
(1)燃烧后生成CO2和H2O的物质的量之比为2的两种常见的烃:_________,_______;一种常见的烃的含氧衍生物:______________。
(2)燃烧后生成H2O和CO2的物质的量之比为2的一种常见的烃:_________。
(3)不能脱水生成烯烃的两种最简单的饱和一元醇:___________,__________。
(4)氧化后生成乙酸的醛:__________;加成后生成乙二醇的醛:___________。

 (5)[ CH2-O ]n的单体:_______________;丙烯聚合后的高分子:__________。
(5)[ CH2-O ]n的单体:_______________;丙烯聚合后的高分子:__________。
27. 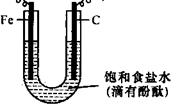 下图是实验室电解饱和食盐水的装置。
下图是实验室电解饱和食盐水的装置。
(1)两根电极材料分别为铁钉和石墨棒,连接
电源负极的是__________(选填“铁钉”
或“石墨棒”,下同),附近出现浑浊的电
极是_______________。
(2)电解饱和食盐水的化学方程式是
_____________________________________。
(3)实验一段时间后,会发现两极产生的气体体积不相等,原因是__________ ___________________________________。
(4)由于采用的食盐是从海水中提取出来的,常含有泥沙、Ca2+、Mg2+、SO42-,可通过化学试剂BaCl2溶液、稀盐酸、NaOH溶液、Na2CO3溶液除去,下列除去杂质的实验顺序合理的是_______________。
A.BaCl2溶液、NaOH溶液、Na2CO3溶液、过滤、稀盐酸
B.Na2CO3溶液、BaCl2溶液、NaOH溶液、过滤、稀盐酸
C.NaOH溶液、BaCl2溶液、Na2CO3溶液、过滤、稀盐酸
D.BaCl2溶液、Na2CO3溶液、稀盐酸、过滤、NaOH溶液
 (5)工业上电解饱和食盐水生产烧碱时,从电解槽中流出的是10%NaOH和16%NaCl的混合液,现按下列流程实验:
(5)工业上电解饱和食盐水生产烧碱时,从电解槽中流出的是10%NaOH和16%NaCl的混合液,现按下列流程实验:
回答:
A.操作步骤①是____________,②是____________,③是_____________。
B.如果晶体A是纯净物,它是__________________。将晶体C提纯的方法称_______________,滤液D中的溶质是___________________。
26.“碘钟”实验中,3I-+S2O82-→I3-+SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(S2O82-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该实验的目的是 。
(2)已知S2O82-离子中,硫元素的化合价为+6价。则S2O82-离子能氧化I-的原因是__________________________________________。
(3)实验⑤中,显色时间t1= 。
(4)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)。
A.<22s B.22-44s C.>44s D.数据不足,无法判断
(5)通过分析比较上表数据,得到的结论是______________________________ ____________________________________________。
25.在一容积为10 L的密闭容器中加入3 mol CO2和1 mol H2,在一定条件下发生反应:CO2(g)+H2(g)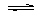 H2O(g)+CO(g)+Q(Q>0),反应至20 min时,容器内各物质的浓度不再发生变化,此时测得CO2的物质的量为2.4 mol。
H2O(g)+CO(g)+Q(Q>0),反应至20 min时,容器内各物质的浓度不再发生变化,此时测得CO2的物质的量为2.4 mol。
(1)从反应开始至达到平衡时的平均反应速率υ(H2)为___________mol/(L•min)。
(2)该反应的平衡常数表达式为_____________________________。
(3)反应达到平衡后,若升高温度,正反应速率_______(填“增大”、“减小”或“不变”,下同),混合气体的压强________,化学平衡常数K________。
(4)当反应进行到第40 min时,若将容器体积缩小到5 L,H2的物质的量变化正确的是________;若降低温度,H2的物质的量变化正确的是________。

24.某一反应体系中存在以下五种物质:Na3AsO3、H2O、I2、Na3AsO4、HI。
(1)用这五种物质组成一个合理的未配平的方程式:
____________________________________________________。
(2)若水是产物,请配平该反应的方程式,并标出电子转移方向与数目:
_____________________________________________________。
(3)pH为5-9时,体系中的氧化反应为HI→I2;当pH<4时,反应方向改变,此时体系中的氧化反应为:__________→___________。
(4)该反应表明溶液的酸碱性影响物质的_________________________(填物质的性质)。
23.A-D是元素周期表中的四种短周期元素,请根据表中的信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质 或 结构信息 |
原子核外s电子与p电子总数相等 |
核电荷核比元素A大8,A与B形成的常见化合物有两种 |
原子有3个电子层,与A组成的化合物和水反应后溶液呈强碱性 |
所有酸和碱中共同的元素 |
(1)上表中与B属于同一周期的元素是________________,写出A离子的电子排布式___________________________。
(2)A与C组成的化合物属于____________晶体。写出由A、B、C三种元素组成的化合物与水反应的离子方程式__________________________________。
(3)对于元素A的单质或化合物的叙述错误的是___________。
A.元素A不显正化合价
B.A与D组成的某种化合物分子中含有18个电子
C.单质A不能直接与氯气反应
D.A与B组成的某种化合物在空气中燃烧后生成另一种A与B组成的化合物
(4)用一个化学方程式表示A与B的非金属强弱_________________________。
(5)写出都由A、B、C、D四种元素组成的两种化合物之间发生反应的离子方程式_____________________________________________。
22.下列离子方程式正确的是 ( )
A.在氢氧化钡溶液中滴加少量稀硫酸:
Ba2++OH-+H++SO42-→BaSO4↓+H2O
B.饱和碳酸钠溶液中通入二氧化碳后溶液浑浊:
2Na++CO32-+CO2+H2O→2NaHCO3↓
C.铜片插入硝酸银溶液中:Cu+Ag+→Cu2++Ag
D.碳酸氢钙溶液中滴入少量氢氧化钠溶液:
Ca2++2HCO3-+2OH-→CaCO3↓+CO32-+2H2O
第Ⅱ卷 (共84分)
21.将下列浓溶液蒸干并灼烧,可以得到原溶质的是 ( )
A.氯化钠 B.碳酸氢钠
C.氯化铁 D.偏铝酸钠
20.CsICl2是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是 ( )
A.Cs显+3价,I、Cl均显-1价
B.Cs显+1价,I显+1价,Cl显-1价
C.在溶液中通入少量Cl2,有单质碘生成
D.在溶液中通入少量SO2气体,有H2SO4生成
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com