
题目列表(包括答案和解析)
8.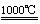 早在1807年化学家戴维用电解熔融氢氧化钠制得钠,4NaOH(熔)
4Na+O2↑+2H2O;
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,4NaOH(熔)
4Na+O2↑+2H2O;
后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH Fe3O4
+2H2↑+4Na↑。下列有关说法正确的是 ( )
A.电解熔融氢氧化钠制钠,阳极发生电极反应为: 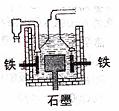
2OH-+2e-==H2↑+O2↑
B.盖·吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖·吕萨克法制得等量的钠,则两反
应中转移的电子总数也相同
D.目前工业上常用电解熔融氯化钠法制钠(如图)
电解槽中石墨极为阳极,铁为阴极
7.X、Y、Z、W有如右图所示的转化关系,则X、W可能是 ( )
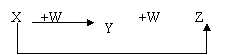 ①C、O2 ②AlCl3、NaOH
①C、O2 ②AlCl3、NaOH
 ③Fe、HNO3 ④S、O2
③Fe、HNO3 ④S、O2
A.①②③ B.①②
 C.③④ D.①②③④
C.③④ D.①②③④
6.在含有大量Ba2+和 的溶液中,能大量共存的离子组是 ( )
的溶液中,能大量共存的离子组是 ( )
A.H+ K+ ClO- Cl- B.H+ NH4+ Fe2+ Br-
C.NH4+
K+ Cl- 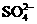 D.K+ Na+ Cl- OH-
D.K+ Na+ Cl- OH-
5.下列离子方程式书写正确的是 ( )
A.AgNO3溶液中加入过量氨水:Ag++NH3H2O===AgOH↓+NH4+
B.把0.4mol铁粉和0.8mol稀硝酸充分反应:Fe+4H++NO3-===Fe3++NO↑+2H2O
C.石灰水与Na2CO3溶液混合:Ca2++ ===CaCO3↓
===CaCO3↓
D.NH4HSO3溶液与足量NaOH溶液也混合:HSO3-+OH-====SO32-+ H2O
4.下述实验能达到预期目的的是 ( )
|
编号 |
实验内容 |
实验目的 |
|
A |
金属钠投入硫酸铜溶液中 |
置换出铜 |
|
B |
向硫酸铝溶液中滴加过量氨水 |
制取氢氧化铝 |
|
C |
将氯化铁溶液加热蒸发 |
制氯化铁晶体 |
|
D |
把铜和银用导线连接后插入稀硫酸中 |
组成原电池验证铜比银活泼 |
3.阿伏伽德罗常数约为6.02×1023mol-1,下列叙述正确的是 ( )
A.2.24LCl2中含有的原子数一定为0.2×6.02×1023
B.0.1L2mol·L-1的Na2CO3溶液中含有CO32-数目为0.2×6.02×1023
C.0.88gC3H8中含有的共价键总数为0.2×6.02×1023
D.7.8g过氧化钠粉末与水反应转移的电子数为0.2×6.02×1023
2.下列药品保存方法正确的是 ( )
A.白磷保存在煤油中 B.在氯化亚铁试剂中加盐酸和铁粉
C.金属钾保存在CCl4中 D.过氧化钠保存配有玻璃塞的广口试剂瓶中
1.2008年的诺贝尔化学奖被三位科学家(见下图)共同获得,以表彰他们在“发现和研究
绿色荧光蛋白(green fluorescent protein 简称GFP)方面做出的贡献”。GFP需要在氧化
状态下产生荧光,强化还原剂能使GFP转变为非荧光形式,但一旦重新暴露在空气或氧
气中,GFP荧光便立即得到恢复。下列说法不正确的是 ( )
 A.GFP是有氨基酸构成的能发出荧光的一类特殊蛋白质
A.GFP是有氨基酸构成的能发出荧光的一类特殊蛋白质
B.可用GFP标记需要研究的蛋白质,研究特定的反应
C.GFP的发光是将化学能转化为光能
D.GFP产生荧光不受外界环境影响
30.现有含等物质的量的KHSO3、NaHSO3的混合物m g与200 mL盐酸反应。假设生成的气体全部从溶液中逸出,且气体体积均以标准状况计。请以具体数值或带有字母的代数式等填写下列空白:
(1)该固体混合物中KHSO3与NaHSO3的质量比为 。
(2)如亚硫酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为________ mol/L。
(3)如果盐酸过量,则生成SO2气体的体积为 L。
(4)如果反应后亚硫酸氢盐有剩余,盐酸不足量,要计算生成SO2气体的体积,还需知道数据是 。
(5)若KHSO3和NaHSO3以任意物质的量之比混合,则m g固体混合物与足量的盐酸完全反应时生成SO2的体积范围是 。
29.将40.0 g CuO加入一定体积密度为1.50 g•cm-3的硫酸溶液中微热,两者均完全反应,冷却恰好得到CuSO4•5H2O晶体。
(1)得到CuSO4•5H2O的质量为_____________g。
(2)原硫酸溶液的质量分数为________,物质的量浓度为_______mol·L-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com