
题目列表(包括答案和解析)
18.(1)向含有0.1mol明矾的溶液中,逐滴加入一定浓度的NaOH溶液,当NaOH的体积
是30mL和190mL时,反应体系中沉淀的质量相等,则NaOH溶液的质量的量浓度是
;若继续加入上述NaOH溶液,当NaOH溶液的体积为 mL时,反应体系
中的沉淀恰好完全溶解。
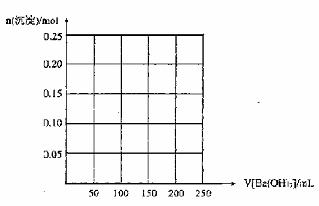
(2)如果上述明矾溶液中滴加1mol/L的Ba(OH)2溶液,请在下图中画出反应体系中产生
的两种沉淀的总物质的量随Ba(OH)2溶液体积V的变化曲线。当溶液中沉淀的总物质的
量最大时,沉淀的质量是 g,体系中能出现的沉淀的最大质量是 g。
17.KMnO4是一种常用的强氧化剂,工业上可以以软锰矿(主要成分MnO2)为原料,通过
液相法生产。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再
用镍板作阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:
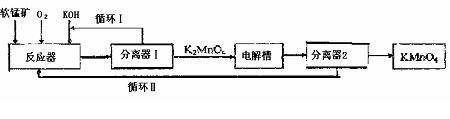
回答下列问题:
(1)写出反应器中反应的方程式
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿中Al、
Si的氧化物含量较高,会导致KOH消耗量偏高,用方程式表示KOH消耗偏高的原因
、 。
(3)写出电解槽中阴极和阳极的电极反应方程式
阴极: ;阳极: 。
在电解法中循环Ⅰ、Ⅱ中利用的共同物质是 。
(4)在传统工艺中,得到K2MnO4后,向其中通入CO2制备KMnO4,配平方程式
K2MnO4+ CO2= KMnO4+ MnO2+ K2CO3
根据上述反应,从Mn元素的角度考虑KMnO4的产率最高为 。与该传统工
艺相比,电解法的优势是 、 。
16.下图表示的反应关系中,部分产物被略去,已知1mol白色固体粉末X完全分解后,恢
复到室温,生成白色固体A,无色液体B,无色气体C各1mol,X、D的焰色反应均为
黄色,G是一种常见金属。
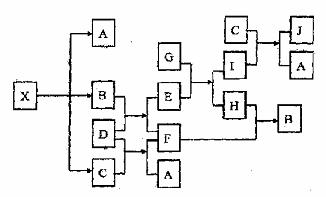
请回答下列问题:
(1)写出下列物质的化学式:X: J:
(2)写出下列物质的电子式:C: D:
(3)写出B+D→E+F反应的化学方程式
(4)写出下列反应的离子方程式
G+E→I+H:
C+I→J+A:
15.甲、乙、丙三个实验小组分别进行测定Na2CO3和NaOH混合物中Na2CO3含量的实验。
(1)甲组:沉淀分析法
把m g混合物溶解后假如过量BaCl2,然后将所得沉淀过滤、洗涤、烘干、称量,固体
质量为w g,根据沉淀质量计算原混合物中Na2CO3质量分数为 。写出反应的
离子方程式 。如果原溶液中过量的Ba2+浓度达到0.01mol/L,则溶液
中残留的CO32-的质量的量浓度是 。(Ksp(BaCO3)=2.58×10-9)
(2)乙组:气体分析法
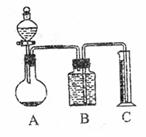 把m g混合物与过量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2
把m g混合物与过量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2
的溶解,B中溶液应是 ,选用该溶液后实
验结果还是不准确,原因是 。针对上述问题,
乙组同学改用测定反应结束后容器A中溶质质量的方
法测定Na2CO3和NaOH混合物中Na2CO3含量,如果
在加热蒸发的过程中操作不当引起固体飞溅,则测出
的样品中Na2CO3的质量分数将 。(填“偏大”或“偏小”)
(3)丙组:滴定分析法
称量m g混合物试样于锥形瓶中,加水使之溶解后,加酚酞指示液2滴,用c mol/LHCl
标准滴定溶液至溶液由红色恰好变为无色(Na2CO3+HCl===NaHCO3+NaCl),消耗HCl
溶液V1mL,然后,加入甲基橙指示液1~2滴,继续用HCl标准滴定溶液滴定至溶液由
黄色变为橙色(NaHCO3+HCl==NaCl+CO2↑+H2O),消耗HCl溶液V2mL。则样品中
Na2CO3的质量分数为 。
14.多硫化钠Na2Sx(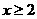 )在结构上与Na2O2,
)在结构上与Na2O2,
FeS2等有相似之处,Na2Sx在碱性溶液中可
被NaClO氧化成Na2SO4,而NaClO被还原
成NaCl,反应中Na2Sx与NaClO的量之比为
1:16,则x值是 ( )
A.5 B.4 C.3 D.2
第Ⅱ卷 (非选择题 共72分)
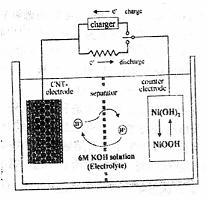
13.一种碳纳米管(氢气)二次电池原理如右图,该电池的电解质为6mol/LKOH溶液,下
 列说法正确的是 ( )
列说法正确的是 ( )
A.储存H2的碳纳米管作电池正极
B.放电时负极附近pH减小
C.放电时电池正极的电极反应为:
NiO(OH)+H2O+e-==Ni(OH)2+OH-
D.放电时,电池反应为2H2+O2→2H2O
12. 下列离子反应方程式正确的是 ( )
下列离子反应方程式正确的是 ( )
A.用两个铜电极电解食盐水:2Cl-+2H2O 2HO-+H2↑+Cl2↑
B.李永刚腐蚀法制作印刷线路板:Fe3++Cu====Fe2++Cu2+
C.Ca(HCO3)2溶液中假如过量KOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
 D.AlCl3溶液呈酸性的原因:Al3++3H2O Al(OH)3+3H+
D.AlCl3溶液呈酸性的原因:Al3++3H2O Al(OH)3+3H+
11.某溶液中可能含有H+、Na+、NH4+、Mg2+、
Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液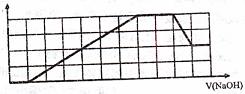
中加入一定物质的量浓度的NaOH溶液时,发
现生成沉淀物质的量随NaOH溶液的体积变
化的图象如右所示,下列说法正确的是 ( )
A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B.原溶液中一定含有SO42-和Na+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D.反应最后形成的溶液中含有的溶质为Na2SO4
10.下列有关金属腐蚀与防护的说法正确的是 ( )
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,
只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0
分)
9.“人文奥运、科技奥运、绿色奥运”是2008年北京奥运会的重要特征。其中禁止运动员
使用兴奋剂的重要举措之一。其中一种兴奋剂X的结构如右所示。下列说法不正确的是
 ( )
( )
A.1molX与足量NaOH溶液反应,最多消耗3molNaOH
B.1molX 与足量浓溴水反应,最多消耗3molBr2
C.X遇FeCl3溶液显色,属于苯酚的同系物
D.兴奋剂X所有碳原子有可能共平面
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com