
题目列表(包括答案和解析)
18.下列说法错误的是( )
A.淀粉水解的最终产物是葡萄糖
B.温度越高,酶的催化率越高
C.乙醒能被弱氧化剂银氨溶液氧化
D.CO2 通入苯酚钠溶液中得到苯酚,说明苯酚的酸性比碳酸弱
17.(12分)25℃时,在0.10mol/L的氨水中逐滴加入同浓度的盐酸直至过量(不计两者的挥发性),回答下列问题:
(1)经测定,25℃时,在0.1 L 0.1mol/L的氨水溶液中c(OH-)=1.3×10-3mol/L,此时一水合氨的电离平衡常数表达式为 。若向该氨水中滴加少量酚酞试液,溶液呈 色;若将上述浓度的氨水稀释10倍,则c(OH-) 1.3×10-4mol/L(用<、>、=填空)。
(2)当溶液PH=7时,溶液中c(NH4+) c(Cl-)(用<、>、=填空),当盐酸和
氨水溶液恰好中和时,溶液丰c(H+) c(OH-) (用<、>、=填空)。
(3)在上述实验中,该溶液PH变化趋势为 ;25℃时,在浓度均为0.1mol/L的氨水和盐酸中,由水电离出来的c(H+)之比约为 。
选考部分
以下是选答题,其中18、19、30、21题为《有机化学基础》模块题,22、23、24、25题为《物质结构与性质》模块题,26、27、28、29、30为《化学与枝术》模块题,考生只能从三个模块中任选一个作答,不得跨模块答题,否则只能以所答的第一个模块计分。
《有机化学基础》模块
18-20为选择题,每小题只有一个正确选项,每小题3分
16. (6分)目前半导体生产展开了一场“铜芯片”革命─在硅心片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,铜的冶炼方法是先用热还原法得到粗铜,然后用电解法精制。
(1)用黄铜矿(主要成分CuFeS2)生产粗铜,其反应原理是
2 CuFeS2
+4O2 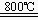 C2S+3SO2+2FeO(泸渣)
C2S+3SO2+2FeO(泸渣)
产物C2S在1200℃时继续反应
2C2S+3O2
 2Cu2O+2 SO2
2Cu2O+2 SO2
2Cu2O+C2S 6Cu+SO2 ↑
6Cu+SO2 ↑
假如上述各步都能完全反应,1000t含杂质8%的黄铜矿最多可得到含铜96%的粗铜为
t.
(2)将粗铜精炼成精铜,在电解糟中,应将粗铜作 极,通常使用 (书写化学式)作电解液,电解时阴极反应式为 。
15.(6分)(1)乙烯在空气中燃烧时火焰明亮伴有少量黑烟,甲烷燃烧时的火焰呈淡蓝色,两种气体燃烧现象不同的原因是 。
(2)25℃、101KPa时,1g甲烷气体完全燃烧生成液态水和CO2气体时放出热量55.6KJ,则甲烷燃烧的热化学方程式为 。
14.(10分)实验探究是体验知识的产生或形成过程的基本途径。下面是某同学探究实验报告的一部分,请填空:
实验名称:氯、溴、碘的氧化性强弱比较
实验药品:NaCl溶液、KBr溶液、KI溶液、氯水、溴水、四氯化碳、淀粉碘化钾试纸
|
实验步骤 |
实验结论 |
|
①NaCl溶液+氯水+1ml
CCl4,振荡、静置、观察Cl4溶液 |
氧化性从强到弱的顺序:氯、溴、碘 |
|
②NaBr溶液+氯水+1ml
CCl4,振荡、静置、观察Cl4溶液 |
|
|
③Kl溶液+氯水+1ml
CCl4,振荡、静置、观察Cl4溶液 |
(1)完成该实验需用到的仪器是 ;
(2)CCl4在实验中所起的作用是 ;
(3)在实验②中四氯化碳层颜色变化过程为 ;
(4)该同学的实验缺陷是 ,改进的办法是 。
13.(10分)已知A、B、C、D、E五种物质所含元素均在周期表的第一、二周期,
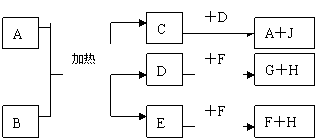 A、C、D、E、F、G、I、J均为化合物,B在常温下为固体单质,C是大气污染物之一,H是常见的单质气体,请根据下图所示填空
A、C、D、E、F、G、I、J均为化合物,B在常温下为固体单质,C是大气污染物之一,H是常见的单质气体,请根据下图所示填空
(1)A的化学式为 ,C的化学式为 ,E和F反应生成I和H的化学方程式为 。(2)C少量时可用NaOH溶液除去,C大量时可用NH3与其在一定条件下反应,产物可直接排入大气,NH3与C物质反应的化学方程式为 ,此反应中NH3做
(氧化、还原)剂。
12.在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积KSP(25℃)如下:
|
|
AgCl |
Agl |
Ag2S |
|
KSP(单位省略) |
1.8×10-10 |
1.5×10-16 |
1.8×10-50 |
下列论述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C. AgCl固体在等物质的量浓度的NaCl、CaCl2 溶液中的溶解度相同
D. 25℃时,在饱和AgCl、Agl、Ag2S溶液中,所含Ag+的浓度不同
第Ⅱ卷(共64分)
11.在恒温恒容下发生反应:N2(g)+3H2(g)=2NH3(g);△H<0。下列判断不正确的是
A.30s内,H2的浓度改变了0.30mol/L,则平均反应速率v(NA)=0.01 mol/L·s
B.当气体总压不随时间改变时,表明该反应达到平衡状态
C.使用铁触媒可明显减少达到平衡的时间
D.降温可提高N2的转化率
10.下列物质分类正确的是( )
A. Ca(OH)2难溶于水属非电解质
B.SO2能与碱反应生成盐和水属于酸性氧化物
C.NH4Cl组成中不含金属离子不属于盐
D.HCl气体溶于水电离成H+和Cl-属于离子化合物
9.下列解释错误的是( )
A.手不能直接接触氢氧化钠固体,是因为氢氧化钠具有强烈的腐蚀性
B.浓硝酸用棕色瓶保存,是因为硝酸不稳定,见光易分解
C.阳光照入房间可看到光柱,是因为尘埃气溶胶的丁达尔现象
D.医院透视用硫酸钡作“钡餐”,是因为硫酸钡性质稳定不溶于水可溶于酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com