
题目列表(包括答案和解析)
23.( 07全国卷II)用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是_______、B元素是_______、C元素是_______(用元素符号表示)
(2)D是由两种元素组成的双原子分子,其分子式是___________。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是___________。
(4)F是由两种元素组成的三原子分子,其分子式是___________,电子式是____________。
(5)G分子中含有4个原子,其分子式是_____________。
(6)H分子中含有8个原子,其分子式是_____________。
22.(新课标高考题)(08宁夏卷)X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
21.(08全国Ⅱ卷)Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,
(1)Q的最高价氧化物,其固体属于________晶体,俗名叫_____________。
(2)R的氢化物的分子的空间构型是_____________,属于____________分子(填“极性”或“非极性”),它与X形成的化合物可作为一种重要陶瓷材料,其化学式是___________。
(3)X的常见氢化物的空间构型是____________;它的另一种氢化物X2H4是一种火箭燃料的成分,其电子式是__________。
(4)Q分别与Y、Z形成的共价化合物的化学式是_______和_______;Q与Y形成的分子的电子式是____________,属于______________分子(填“极性”或“非极性”)。
20.
 (04江苏卷)下列各项中表达正确的是( )
(04江苏卷)下列各项中表达正确的是( )
A.F-的结构示意图: B.CO2的分子模型示意图:
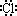 C.NaCl的电子式:Na
D.N2的结构式:∶N≡N∶
C.NaCl的电子式:Na
D.N2的结构式:∶N≡N∶
考点3 综合应用
19.(06广东卷)SO42-和 S2O82-结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是( )
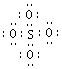
A. SO42-的电子式为 B.S2O82-中没有非极性键
C.S2O82-比SO42- 稳定 D.S2O82-有强氧化性
18.(06江苏卷)氢元素与其它元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
A.一个D2O分子所含的中子数为8
B.NH3的结构式为H-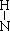 -H
-H
C.HCl的电子式为H +[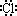 ]- D.热稳定性:H2S>HF
]- D.热稳定性:H2S>HF
17.(06全国卷)下列叙述正确的是( )
A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C.H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
D.CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线的中央
16.(07天津卷)下列关于粒子结构的描述不正确的是( )
A. H2S和NH3均是价电子总数为8的极性分子
B. HS-和HCl均是含一个极性键的18电子粒子
C. CH2Cl2和CCl4均是四面体构型的非极性分子
D. 1 mol D216O中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值)
15.(08天津卷)下列叙述正确的是( )
A.1个甘氨酸分子中存在9对共用电子
B.PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构
C.H2S和CS2分子都是含极性键的极性分子
D.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅
14.(08全国Ⅰ卷)下列叙述中正确的是( )
A.NH3、CO、CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.HF、HCl、HBr、Hl的稳定性依次增强
D.CS2、H2O、C2H2都是直线型分子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com