
题目列表(包括答案和解析)
8.下列实验操作中,正确的是
①用托盘天平称取5.2 g NaCl;②用50 mL 量筒量取5.2 mL盐酸;③用蒸发皿加热NaCl溶液可以得到NaCl晶体;④用100 mL容量瓶配制50 mL 0.1 mol·L-1 H2SO4溶液;⑤用带玻璃塞的棕色试剂瓶存放浓HNO3;⑥中和热测定的实验中使用的玻璃仪器只有2种
A.①③⑤ B.②④⑥ C.①③④ D.③⑤⑥
7.金属钠不仅跟氧气、水等无机物反应,还能跟酒精、醋酸等有机物反应。要研究金属钠跟酒精反应的性质以及它与水反应的异同点,下列研究方法中没有用到的是
A.实验法 B.观察法 C.分类法 D.比较法
6.下列有关化学实验的操作或说法中,正确的是 ( )
A.用有少量蒸馏水的锥形瓶装待测液进行中和滴定实验,对测定结果没有影响
B.在进行硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行4次
C.苯酚中滴加少量稀溴水出现三溴苯酚白色沉淀
D.检验溴乙烷中的溴元素时,将溴乙烷和氢氧化钠溶液混合加热后,需加硫酸酸化
5.当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀又逐渐溶解成为深蓝色的溶液,向深蓝色的溶液中通入SO2气体,又产成白色沉淀;将白色沉淀加入稀硫酸中,又生成红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下列描述正确的有 A.Cu2+和Ag+相似,能与NH3结合生成铜氨络离子
B.白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应
C.白色沉淀为+1价铜的某种亚硫酸盐,溶于H2SO4发生自身氧化还原反应
D.反应过程中消耗的SO2与生成的SO2的物质的量相等
4、实验①:向盛有0.1mol / LAgNO3溶液的试管中滴加0.1mol / L的NaCl溶液至不再有白色沉淀生成为止。取上层澄清溶液,逐滴加入饱和Na2S溶液。
实验②:向盛有0.1mol / LAgNO3溶液的试管中滴加饱和Na2S溶液至沉淀完全,取上层澄清溶液,逐滴加0.1mol / L的NaCl溶液。对上述实验结果的现象描述正确的是:
A.实验①有黑色沉淀,实验②有白色沉淀 B.实验①有黑色沉淀,实验②无沉淀
C.实验①无沉淀,实验②有白色沉淀 D.实验①和实验②都无沉淀
3、为证明CuSO4溶液显蓝色与Cu2+有关而与SO42-无关,某同学设计了下列实验,其中对实验目的没有意义的是:①、观察稀硫酸颜色 ②、观察无水硫酸铜粉末颜色
③、稀释CuSO4溶液,观察溶液蓝色变化
④、往CuSO4溶液中滴加少量NaOH溶液,生成蓝色沉淀,过滤,观察滤液颜色变化
⑤、往CuSO4溶液中滴加足量BaCl2溶液,生成白色沉淀,过滤,观察滤液颜色变化
A、①②④ B、②③④ C、②③⑤ D、①④⑤
2、对照实验是研究物质性质的一种重要方法,下列不是用来作对照实验的是:

1.在实验室中从苯酚中分离出苯,可选用下列装置中的
|
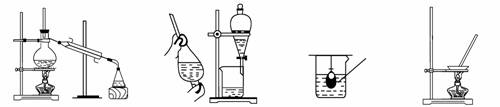
A. B. C. D.
0.02mol 0.02mol
根据反应耗用盐酸的量列方程求解
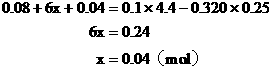
Fe2O3的质量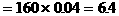 (g)
(g)
Fe的质量 (g)
(g)
解法二:
设混合物中含铁的物质的量为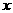 ,Fe2O3的物质的量为
,Fe2O3的物质的量为
根据氧化还原反应中的电子守恒

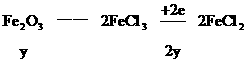
2H+--H2得电子的物质的量0.04×2(mol)
CuO--Cu得电子的物质的量0.02×2(mol)
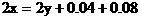
根据 守恒列方程
守恒列方程
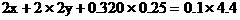
解方程组

Fe的质量
Fe2O3的质量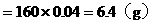
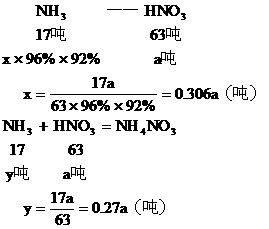
例2:某化工厂用NH3制备NH4NO3。已知NH3制NO的产率是96%;NO制HNO3的产率是92%,HNO3与NH3反应生成NH4NO3。则制HNO3所用去NH3的质量占总耗NH3的质量的百分比是多少?(不考虑生产上的其它损耗)
分析:根据反应
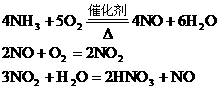
由于生产中NO2与H2O反应生成HNO3和NO,不断地补充空气使NO多次被氧化成NO2,被水吸收,最后比较完全转化HNO3,因此,第三步反应在考虑到循环反应后可用下式表示:

由以上四个反应可得最初反应物与最终产品的关系式:
4NH3-4NO-4NO2-4HNO3
设生产 耗用NH3为x吨,生产NH4NO3耗用NH3 y吨
耗用NH3为x吨,生产NH4NO3耗用NH3 y吨
生产HNO3耗用NH3的质量百分比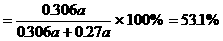
答:略。
例3:金属锡的纯度可以通过下述方法分析:将试样溶于盐酸,反应的化学方程式为:Sn+2HCl=SnCl2+H2 再加入过量的FeCl
再加入过量的FeCl 溶液,发生如下反应:SnCl2+2FeCl
溶液,发生如下反应:SnCl2+2FeCl =SnCl4+2FeCl2最后用已知浓度的K2Cr2O7溶液滴定生成Fe2+,反应的化学方程式为:
=SnCl4+2FeCl2最后用已知浓度的K2Cr2O7溶液滴定生成Fe2+,反应的化学方程式为: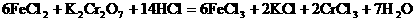 现有金属锡试样0.613g,经上述反应后,共用去0.100
mol/LK2Cr2O7溶液16.0mL。求试样中锡的百分含量(假定杂质不参加反应)。
现有金属锡试样0.613g,经上述反应后,共用去0.100
mol/LK2Cr2O7溶液16.0mL。求试样中锡的百分含量(假定杂质不参加反应)。
分析:该题是应用关系式法解多步反应的综合计算。根据题目所给出的三个化学反应,得出Sn与K2Cr2O7的物质量的关系。
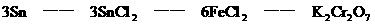
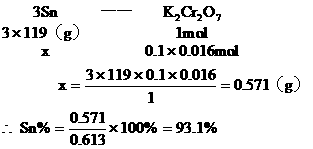
答:略。
例4:在100mL 36.5%的浓盐酸(密度为1.18g/cm3)中加入多少mL 2mol/L的稀盐酸(密度为1.08g/cm3),才能配成6mol/L的盐酸(密度为1.10g/cm3)。
分析:任何溶液在稀释时,溶液和溶剂的量都要发生变化,但溶质的量不变,据此可以得到稀释下列各种浓度的溶液计算公式。
百分比浓度溶液的稀释公式:
浓溶液的质量×浓溶液的浓度 = 稀溶液的质量×稀溶液的浓度
mol尔浓度的溶液稀释公式:
浓溶液的浓度×浓溶液的体积(L) = 稀溶液的浓度×稀溶液的体积
同一溶质的两种不同浓度的溶液混合时,混合溶液的浓度介于溶液之间,混合液跟两原溶液中溶质、溶液量的基本关系是:
(1)混合液中所含溶质的总量等于两原溶液的溶质质量之和。
(2)混合溶液的质量等于两原溶液的质量之和,但体积不等于两原溶液的体积之和(当两原溶液很稀时,通常把混合液的体积近似地看做两原溶液的体积之和。)
在应用上述关系进行复杂的混合溶液计算时,可先算出混合溶液的总质量和溶质的总质量,然后再求出混合溶液的浓度。
设需加入VmL 2mol/L的盐酸
混合液中溶质的总物质的量
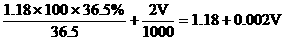
混合溶液的总体积:

混合液的物质的量浓度:
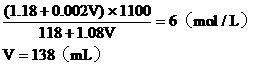
答:略
例5:氯气通入氨水中发生下列反应: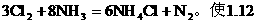 L氯、氮混合气(90%Cl2、10%的N2)通入浓氨水实验测得逸出气体在标况下为0.672L(50%的Cl2、50%的N2),问在反应中有多少g氨被氧化?
L氯、氮混合气(90%Cl2、10%的N2)通入浓氨水实验测得逸出气体在标况下为0.672L(50%的Cl2、50%的N2),问在反应中有多少g氨被氧化?
分析:设有xg氮气被氧化
由方程式可得出:


答:略。
例6:以等物质的量混合的两种价态相同的无水金属氯化物29.6g,与水结合可得这两种氯化物的六水合物共51.2g。将这两种水合物的混合物强热灼烧变成氧化物的混合物(金属的价态不变)13.1g;如果将原混合物溶于水,加过量的氢氧化钠溶液,把得到的沉淀物滤出,洗净,高温灼烧后称量为8g,试推导出这两种氯化物各是什么物质。
分析:设这两种金属氯化物的化学式分别为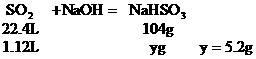 两元素的原子量分别为
两元素的原子量分别为 。
。
(1)由两种氯化物的结晶水的含量可求出氯化物的物质的量。
氯化物的物质的量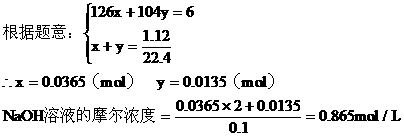
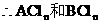 各为0.1mol
各为0.1mol
(2)由两种氯化物强热灼烧转变为氧化物所减少的质量,可求出氯化物中金属元素的化合价n。

(3)求两种金属的原子量:
原混合物加过量的NaOH溶液后,得到沉淀高温灼烧,剩余物质的质量比混合物强热后灼烧所得氧化物混合物的质量小,说明所剩余物只是一种氧化物为A2O3。
根据:

又:
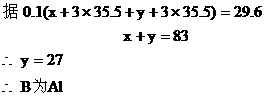
 两种氯化物分别为FeCl3和AlCl3。
两种氯化物分别为FeCl3和AlCl3。
例7:将5.000gNaCl、NaBr、CaCl2的混合物溶于水,通入氯气充分反应,然后把溶液蒸干并灼烧,得残留物4.914g。灼烧后的残留物再溶于水,并加足量的Na2CO3溶液,所得沉淀经干燥后质量为0.270g。求混合物中各化合物的质量百分组成。
分析:根据题意可列出下图示,帮助审清题意,找出思路和解法。
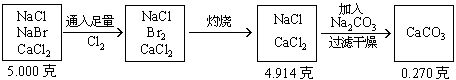
根据图示可分析:
(1)CaCO3的质量为0.270g,由它可求出CaCl2的质量。

(2)混合物中通入Cl2
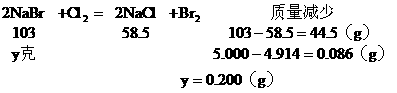
(3)NaCl的质量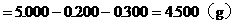
(4)各组分的百分含量
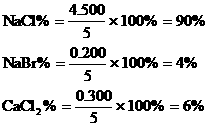
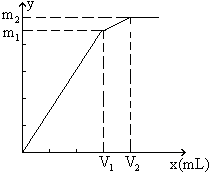
例8:向含0.02mol Al3+的明矾溶液中,逐滴加入0.1mol/L的Ba(OH)2溶液时,产生沉淀的质量y(g)与Ba(OH)2溶液的体积x(mL)的关系如图所示。求图中:
V1=
V2=
m1=
m2=
分析:本题要从分析图中所体现的产生沉淀的质量与加入Ba(OH)2体积的函数关系求出V1、V2和m1、m2的值。
从图中可以看出,当加入V1mL的Ba(OH)2时,可得沉淀m1 g,沉淀为BaSO4和Al(OH)3,当加入V2mL Ba(OH)2时,Al(OH)3溶解,沉淀仅为BaSO4。
(1)含有0.02mol Al3+的明矾溶液中含有0.04mol的SO42-。
当加入V1mL Ba(OH)2时,

(2)当加入V2mL Ba(OH)2溶液时,
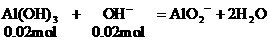
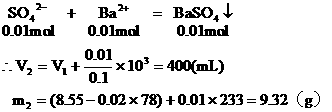
例9:某金属R 7g跟足量的盐酸反应,在标准状况下,可得2.8L氢气;11.2g该金属可跟21.3g氯气完全反应,生成相应的氯化物,求该金属的原子量。
分析:设R的原子量为m,两种金属氯化物的分子式分别为RClx和RCly
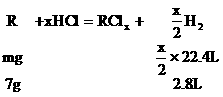
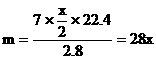 ………①
………①
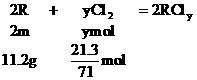
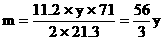 ………②
………②
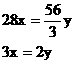
讨论:(1)当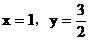 不合理
不合理
(2)当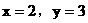 合理
合理
(3)当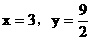 不合理
不合理
例10:混合两种未知物的溶液,生成1.25g沉淀,这个沉淀是二价金属盐。在1000℃灼烧,使沉淀完全分解,得到质量为0.70g的固体金属氧化物和另一种使石灰水变浑浊的无刺激性气味的气体。蒸发滤除沉淀后的溶液,得到2.0g干燥残渣。在200℃时慢慢加热残渣,使它分解仅得到两种产物:一种是气态氧化物,标况下的体积为0.56L,另一种是水,为0.90g,试确定未知物是什么,并写出有关推理,计算过程及化学方程式。
分析:能使石灰水变浑浊且无刺激性气味的气体应是CO2,故1.25g沉淀应为碳酸盐。
设碳酸盐的分子式为MCO3
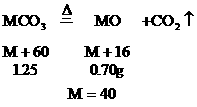
 此二价金属为Ca。
此二价金属为Ca。
 滤液蒸干后得2.0g残渣,受热分解为0.90g水和0.56L气态氧化物。
滤液蒸干后得2.0g残渣,受热分解为0.90g水和0.56L气态氧化物。
 此气态氧化物的mol尔质量为:
此气态氧化物的mol尔质量为:
 (g/mol)
(g/mol)
分解产物的mol尔比:
H2O∶RxOy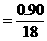 ∶
∶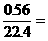 0.05∶0.025
0.05∶0.025 2∶1
2∶1
 分解产物为H2O和气态氧化物,分解温度为200℃,故此盐为铵盐,并不可能是碳酸铵或碳酸氢按(因分解产物是3种)
分解产物为H2O和气态氧化物,分解温度为200℃,故此盐为铵盐,并不可能是碳酸铵或碳酸氢按(因分解产物是3种)
 此盐只能是NH4NO3
此盐只能是NH4NO3
设其分解产物为H2O和NxOy
则对NxOy而言有
则
讨论, 均为正整数,且只可能是1或2,
均为正整数,且只可能是1或2,
(1)若
(2)若
由此可肯定此盐为NH4NO3,热分解产物为H2O和N2O。
 未知物是
未知物是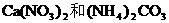
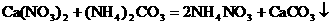
例11:两种烃的混合气体20mL,跟过量的氧气混合点燃,当产物通过浓H2SO4时,体积减小30mL,通过碱石灰后的体积又减少40mL(以上均换算成标准状况的体积),问该混合物的组成可能有几种?在各种可能组成中,每种烃各是多少?
分析:气态烃的碳原子数都小于4。20mL混合烃完全燃烧生成40mL CO2和30mL水蒸气,可知1mol混合烃平均含2mol C原子和3mol H原子,从而推知,该混合烃只能是C2H6和C2H2或C2H4和C2H2的混合物。
讨论:
(1)若混合烃含有x mL C3H6,则含有(20-x)mL C2H2

由题意可知:
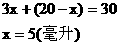
C2H2:20-5=15(mL)
(2)若混合烃含有y mL C2H4,则含有 ,
,
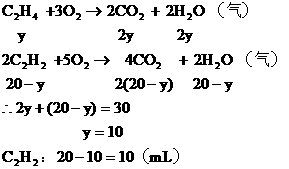
 可能有两种组合
可能有两种组合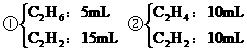
例12:现有氧化铜和碳粉的混合物共Amol,将它在隔绝空气条件下加热,反应完全后,冷却,得到残留固体。
(1)写出可能发生反应的化学方程式
(2)若氧化铜在混合物中的量的比值为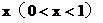
问:x为何值时,残留固体为何种物质?写出残留固体的物质的量与x值之间 的关系。将结果填入下表。
|
|
残 留 固 体 |
|
|
x值 |
分 子 式 |
物质的量 |
|
|
|
|
分析:(1)首先写出有关的化学反应方程式,根据化学方程式中有关物质间的物质的量的关系,分析当CuO恰好完全反应时,x值是多少?
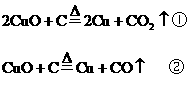
按①式反应,x值为 时,反应物恰好反应;按②式反应,x值为
时,反应物恰好反应;按②式反应,x值为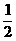 时,反应物恰好完全反应。
时,反应物恰好完全反应。
(2)当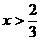 时,CuO过量,按C的量计算。
时,CuO过量,按C的量计算。
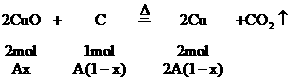
剩余CuO的物质的量
(3)当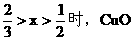 不足量,按CuO的量计算,生成铜的量为Ax。
不足量,按CuO的量计算,生成铜的量为Ax。
(4)当 时,C过量,按②式中的CuO的量计算,生成铜为Ax,剩余C的物质的量为:
时,C过量,按②式中的CuO的量计算,生成铜为Ax,剩余C的物质的量为:
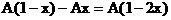
将所得结果的有关数值填入下表:
|
x 值 |
残 留 固 体 |
|
|
|
分 子 式 |
物 质 的 量 |
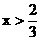 |
Cu CuO |
2A(1-x) A(3x-2) |
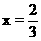 |
Cu |
Ax(或 A) A) |
 |
Cu |
Ax |
 |
Cu |
Ax(或 ) ) |
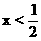 |
Cu C |
Ax A(1-2x) |
例13:80℃,101.3千帕下,用下图装置进行如下实验。A、C两筒内分别装有无色气体。它们可能是NH3、O2、N2、H2S、NO、CO2等气体,B管内装有固体。推动A的活塞使A筒中的气体缓缓地全部通过B进入C筒,C中的气体由无色变成红棕色,但其体积换算成同温同压下却并未变化。
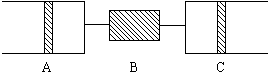
(1)C中发生的反应,其化学方程式是 。已知原C中的气体为单一气体,它是 。(若有多种可能答案,需一一列出。)将反应后C筒中的气体,用水吸收后,气体体积,减小一半,则与水反应前C中的气体是 。(若有多种答案需一一列出。)
(2)若实验开始前A、C中的气体体积(换算成标况)分别为1.40L和2.24L,且A中的气体经过B管后,B管增重1.40g,通过计算和推理可判定A中的气体是 ,其质量是 g。
分析:本题要求学生将分子量、物质的量、气体摩尔体积、化学方程式计算与元素及其化合物的性质结合起来,根据试题给出的条件,进行分析、推理和论证。
(1)由C筒中发生的化学现象气体由无色变为红综色,可判断C中发生的化学反应为:2NO+O2=2NO2;又根据C筒中的气体反应后并无体积变化,可知C中为NO,由B管进入C中气体为纯O2,反应后O2并未过量。与水反应后,气体体积减半,已知与水反应前C筒中的气体为NO2和NO的混合气。
(2)设与水反应前C筒中NO2的体积为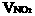 ,NO为
,NO为 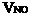 ,根据题意列方程组:
,根据题意列方程组:
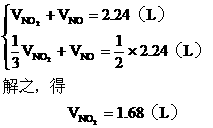
 由B管进入C筒中的
由B管进入C筒中的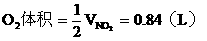
若0.84L O2全部由A筒中来,则A中除O2外,另一种气体的体积为1.40-0.84=0.56L,根据B管增重1.40g,该气体的mol尔质量为:

对照试题所给出的已知气体中没有一种气体的mol尔质量等于或大于56g/mol,因此该气体不是其中的一种,也不可能是其中两种或多种的混合气。由此可以确定C筒的O2可能全部或部分是由A中的某气体跟B管中的固体反应而得。已知气体能跟固体反应生成O2的只有CO2:

讨论:(1)若A中的气体全部是CO2(即进入C的O2全部由CO2和Na2O2反应而得。)根据反应方程式1.40L CO2与 反应生成O2的体积为
反应生成O2的体积为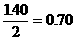 (L)这与进入C筒中O2的体积不符。(0.84 L)
(L)这与进入C筒中O2的体积不符。(0.84 L)
(2)若A中的气体是CO2和O2的混合气。设A中CO2和O2的体积分别为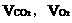 。
。
根据题意
解题: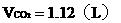
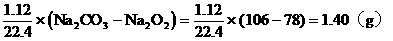
 该结果与题设条件相符,所以A中的气体是CO2和O2的混合气体。
该结果与题设条件相符,所以A中的气体是CO2和O2的混合气体。
A中的气体的质量 。
。
例14:向100g 25%的A醛溶液中加入B醛19g,B醛的分子式比A醛分子多一个CH2原子团。用2g这种混合醛溶液与足量的银氨溶液反应,析出了3.24g银,问A醛和B醛各是什么醛?
分析:解题的关键是抓住3.24g银的质量求出混合醛的物质的量,再根据混合醛的质量,求出混合醛的平均分子量,最后用不等式的讨论确定A醛和B醛。
设2g此溶液中A、B总的物质的量为xmol
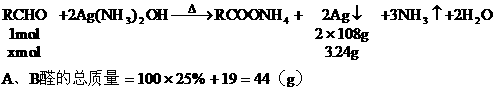
2g混合溶液中含有A醛和B醛的质量为:
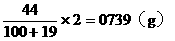
混合醛的平均分子量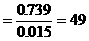
设A醛、B醛分子式分别为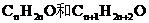 ,则A、B的分子量分别为14n+16、14n+30
,则A、B的分子量分别为14n+16、14n+30

例15:今有分子组成相差1个碳原子和若干个氢原子的两种单烯烃的混合物,若取该单烯烃混合物的质量为42g时,则其物质的量已大于1mol。在温度为120℃时向密闭容器中充入1mol混合烃和足量的氧气,引燃,待反应完全后,再恢复到120℃,容器内的压强比原来有所增大。
(1)试确定原混合烃中两种单烯烃的分子组成。
(2)为了使该混合烃对氧气的密度≥1.05g/cm3,且在上述条件下完全燃烧产生气体增加的物质的量≤0.3mol。通过计算,讨论两种烃的物质的量之比应满足什么条件。
分析:
(1)取单烯烃混合物为42g时,其物质的量>1mol。
∴混合烃的平均分子量≤42
∴该混合烃的组成C2H4和C3H6
(2)该混合烃的平均分子量≥33.6(1.05×32)
设混合烃中C3H6为x mol,C2H4为y mol
则 
解得 
又∵燃烧产物增加的物质的量由C3H6燃烧所致
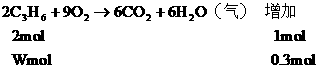
∴ 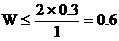
∴C2H4的物质的量≥0.4
∴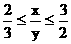
以上总结了化学计算的主要解题方法。但要适应当前的高考,还要掌握一定的解题技巧,“技巧”就是培养思维方法的,掌握了一定的技巧,就可以g服思维定势,诱导发散思维,培养思维的敏捷性和思路的灵活性,达到解题时随机应变,快速准确。
例16:把过量的Fe粉投入到FeCl3和CuCl2组成的混合溶液中,充分搅拌,反应后过滤、干燥,称得不溶性物质的质量与加入铁粉的质量相等。求混合物中FeCl3和CuCl2的物质的量之比是多少?
分析:设CuCl2为xmol、FeCl3为ymol。
铁粉投入FeCl3和CuCl2的混合溶液中,发生下列反应:

反应后所得不溶物为铜粉和过量的铁粉。按题意,反应中与FeCl3和CuCl2反应而消耗铁粉的质量与置换出铜粉的质量一定相等,按比等量关系用代数法求解。
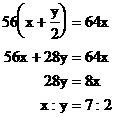
例17:15℃时,某2价金属硫酸盐的饱和溶液,其百分比浓度为25%,取足量的此饱和溶液,加入1g这种硫酸盐的无水盐,结果析出了3.15g这种硫酸盐的含7个结晶水的晶体。通过计算确定该金属是何种元素。
分析:设二价金属元素为R,原子量为x
根据溶质质量守恒,可列出一元一次方程
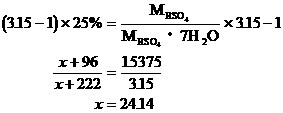
 该金属为镁。
该金属为镁。
例18:在一定条件下,可逆反应达平衡: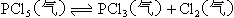 ,已知平衡混合气的平均分子量为149,求平衡混合气中PCl5的百分含量。
,已知平衡混合气的平均分子量为149,求平衡混合气中PCl5的百分含量。
分析:求平衡混合气中PCl5的体积百分含量即求PCl5的mol尔百分含量。因此就要求出平衡时混合气的总的物质的量及PCl5的物质的量。
设PCl5的起始物质的量为amol,转化的物质的量为xmol。
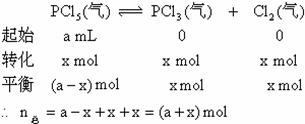
根据质量守恒定律 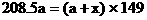

则平衡时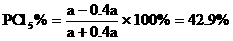
例19:已知NO2与NaOH溶液反应:
3NO2+2NaOH=2NaNO3+NO+H2O,NO和NO2可一起与NaOH溶液作用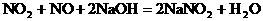 现欲用V L某烧碱溶液使由nmol NO和m mol NO2组成的混合气体中的氮全部进入溶液中,NaOH溶液的物质的量浓度至少为多少?
现欲用V L某烧碱溶液使由nmol NO和m mol NO2组成的混合气体中的氮全部进入溶液中,NaOH溶液的物质的量浓度至少为多少?
分析:NO和NO2的混合气体与NaOH溶液反应,产物为NaNO2,产物中Na+与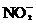 的物质的量比为1∶1,根据反应中Na+与N原子的物质的量守恒,可列出方程。
的物质的量比为1∶1,根据反应中Na+与N原子的物质的量守恒,可列出方程。
设NaOH溶液的物质的量浓度为x。
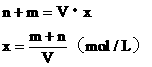
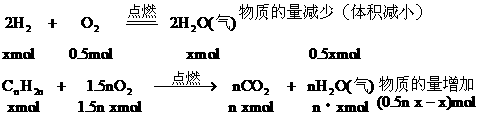
例20:在120℃的条件下,在密闭容器中混有等物质的量的H2和某烯烃,充入足量的O2,点燃使其燃烧,然后恢复到原温度,发现反应前后容器内压强相等。求该烯烃的分子式。
分析:由于密闭容器内的压强反应前后相等,根据阿佛加德罗定律可知反应前后物质的量总数不变。因H2燃烧使气体的物质的量减少,而烯烃燃烧必然使气体的物质的量增加,且增加与减少的量相等。
设混合气中含H2和烯烃各xmol
根据题意: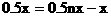
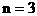
 该烯烃的分子式为C3H6
该烯烃的分子式为C3H6
例21:把2.56g纯铜放入盛有一定量浓HNO3的大试管中,立即发生化学反应,当铜反应完毕后,共生成气体1.12L(标况),计算此反应中耗用HNO3的物质的量是多少?
分析:铜跟一定量浓HNO3反应,开始生成的还原产物是NO2,后期生成的还原产物是NO,把两个不同反应所生成的还原产物作为整体考虑,而不区分有多少NO2和NO,每生成1mol NOx都耗用1mol HNO3,根据以应前后氮原子守恒,可列方程求解

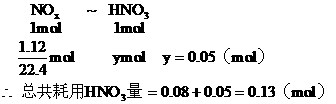
例22:如果用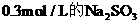 溶液16mL刚好将3.2×10-3mol的强氧化剂
溶液16mL刚好将3.2×10-3mol的强氧化剂 溶液中的溶质还原到较低价态,则反应后R的最终价态是:
溶液中的溶质还原到较低价态,则反应后R的最终价态是:
A.0 B.+1 C.+2 D.+3
分析:Na2SO3可被强氧化剂氧化为Na2SO4,Na2SO3失去电子的物质的量一定等于 得到电子的物质的量。设
得到电子的物质的量。设 中R元素的化合价降低为x价
中R元素的化合价降低为x价
依题意列出方程
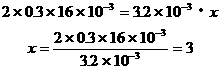
 R元素由+5价降低了3价,被还原产物中R元素的化合价为+2价。
R元素由+5价降低了3价,被还原产物中R元素的化合价为+2价。
答案:C
例23:将7.28g Fe溶于过量的稀H2SO4中,在加热的条件下,用2.02gKNO3去氧化溶液中Fe2+,待反应完全后,剩余Fe2+还需0.4mol/L KMnO4溶液25mL才能完全氧化,已知其反应方程式为: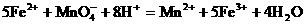 。通过计算、确定KNO3的还原产物是什么?(还原产物为氧化物)并写出其离子方程式。
。通过计算、确定KNO3的还原产物是什么?(还原产物为氧化物)并写出其离子方程式。
分析:该题中Fe已全部被转化为Fe2+,因此Fe2+与KNO3、KMnO4的氧化还原反应中,还原剂为Fe2+,氧化剂为KNO3、KMnO4,根据电子得失守恒列方程。
Fe2+失去电子的物质的量= KMnO4得到电子的物质的量+KNO3得到电子的物质的量
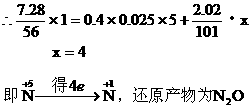
离子方程式: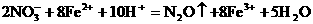
例24:在常温下,把氨水滴到盐酸中,当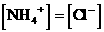 时混合溶液的pH值为
时混合溶液的pH值为
A.大于7 B.小于7 C.等于7 D.无法判断
答案:C。
分析:此题若不仔细分析,似乎无从下手,很容易错选D或认为弱碱向强酸溶液滴加,因此混合溶液应呈酸性,而导致错选B。若能根据电荷守恒的原理进行分析,即可迎刃而解。由氨水电离产生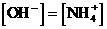 ,由盐酸电离产生
,由盐酸电离产生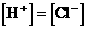 ,可知:混合溶液中
,可知:混合溶液中 。
。
故选C。
例25:镁条在空气中燃烧生成氧化镁和氮化镁。将燃烧后的产物溶解在60毫升浓度为2.0mol/升的盐酸中,再用20毫升0.5mol/升NaOH溶液中和多余的盐酸,然后在此溶液中加过量的碱,把氨全部蒸出来,用稀HCl吸收,稀HCl增重0.17g,求镁带的质量。
分析:此题涉及反应较多,如按常规计算非常复杂,如巧用电荷守恒法可使计算大为简化。
该题反应变化的图式:
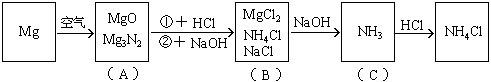
在图(B)中,根据电荷守恒,有下列关系:
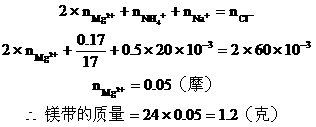
答:略。
例26:两种金属混合物20.75g,投入到足量的稀盐酸中,反应完全后得到11.20L的氢气(标况),此金属混合物是。
A.Mg和Al B.Fe和Zn C.Al和Fe D.Mg和Cu
分析:当金属混合物失去1mol电子时才能有标准状况下的11.2L氢气的产生。20.75g是平均值,两种金属分别失去1mol电子所需质量必定一多一少,失去1mol尔电子时需Mg、Al、Fe、Zn的质量分别为12g、9g、28g、32.5g,Cu不与稀盐酸反应,所以C、D两选项为本题的答案。
答案:C、D。
例27:丙烯和某种气态烃组成的混合气完全燃烧所需氧气的体积是混合气体的3倍(气体体积均在相同状态下测定),求烃的分子式。
分析:两种烃燃烧消耗O2的体积数是平均值,根据“一大一小”确定另一种烃燃烧消耗O2的体积范围,再讨论其分子组成的可能性。
丙烯燃烧消耗O2: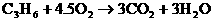
1体积丙烯完全燃烧消耗4.5体积的O2,则另一种气态烃完全燃烧消耗O2的体积一定小于3倍烃的气体体积。设该烃的分子式为CxHy

讨论:①当
②
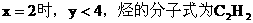
例28:饱和烃A和不饱和烃B在常温下均为气体,其中A含C原子数多于B。
(1)将A、B按一定比例混合。1L混合气完全燃烧后在同温、同压下得到3.6L CO2。试推断该混合气的可能组合及A、B混合时的体积比。将结果填入下表。
|
A的分子式 |
B的分子式 |
VA∶VB |
|
|
|
|
(2)1mol该混合气体恰好能使含0.4mol溴的CCl4溶液完全褪色,推断上述组合中符合该条件的A与B的分子式并填入下表
|
A的分子式 |
|
|
|
B的分子式 |
|
|
分析:(1)本题是用计算推理方法确定混合烃的组成。1L碳原子数为n的烷烃或烯烃充分燃烧均得到nL CO2。由题意推断,该混合烃只能由碳原子数大于3.6的烷烃和碳原子数小于3.6的烯烃或炔烃组成。它们可能有四种组合,根据每种组合中烷烃和不饱和烃的碳原子数及燃烧后生成CO2的体积可能有四种组合,根据每种组合中烷烃和不饱和烃的碳原子数及燃烧后生成CO2的体积可确定A和B的体积比。例如:若A为C4H10,B为C2H4。设1升混合气中含C4H10为x L,含C2H4为(1-x)L,它们充分燃烧后分别得到4x升CO2和2(1-x)L CO2,根据1升混合气燃烧后得到3.6LCO2,可得4x+2(1-x)=3.6

也可用十字交叉来解:
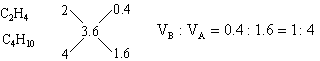
其它组合可依此类推,于是得到:
|
组合的编号 |
A的分子式 |
B的分子式 |
 |
|
① |
C4H10 |
C2H4 |
4∶1 |
|
② |
C4H10 |
C2H2 |
4∶1 |
|
③ |
C4H10 |
C3H6 |
3∶2 |
|
④ |
C4H10 |
C3H4 |
3∶2 |
(2)1L混合气可使含0.4mol溴的CCl4溶液完全褪色,说明混合气中不饱和烃与溴的物质的量比为1∶2,符合这一条件的只有②、③的两种组合。
|
A的分子式 |
C4H10 |
C4H10 |
|
B的分子式 |
C2H2 |
C3H6 |
例29:铜元素有两种同位素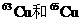 元素的平均原子量为63.35,则两种同位素的原子个数比为
元素的平均原子量为63.35,则两种同位素的原子个数比为 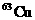 在自然界中的百分含量 。
在自然界中的百分含量 。
分析:应用十字交叉法:
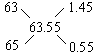 即原子个数比为1.45∶0.55=29∶11
即原子个数比为1.45∶0.55=29∶11
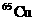 在自然界中的百分含量
在自然界中的百分含量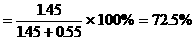
例30:有Wg15%的硫酸铜溶液,若将其浓缩为30%,可采用的方法是
A.蒸发掉溶剂的1/2 B.蒸发掉W/2g溶剂
C.加入3W/14g无水硫酸铜 D.加入3W/14g硫酸铜晶体
分析:(1)设蒸发溶剂xg,溶剂的浓度为0。
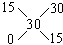
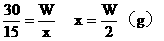
(2)设加入无水硫酸铜为yg,浓度为100%

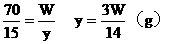
(3)设加入硫酸铜晶体为zg,浓度为64%
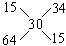

 答案:B、C
答案:B、C
例31:有不同浓度的NaOH溶液各取100mL分别通入SO2 1.12L(标况),完全反应后,分别得到不含结晶水的固体6.00g和7.00g,求这两种溶液的不同浓度值(mol/L)?
分析:SO2与NaOH溶液反应,可能有三种情况:NaOH过量,所得固体为Na2SO3和NaOH的混合物;SO2部分过量,所得固体为Na2SO3和NaHSO3的混合物;SO2极大过量所得固体为NaHSO3,因此本题应首先确定固体的成分。
(1)应用极值法先确定两个极值
a:设SO2与NaOH完全作用生成Na2SO3

b:设SO2极大过量,最终产物为NaHSO3
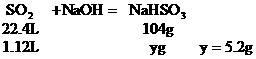
(2)讨论确定产物
a:因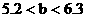 ,所以b g固体为Na2SO3和NaHSO3的混合物
,所以b g固体为Na2SO3和NaHSO3的混合物
b:因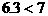 所以7 g固体为Na2SO3和NaOH的混合物
所以7 g固体为Na2SO3和NaOH的混合物
(3)计算
a:第一种情况,设生成Na2SO3为xmol,NaHSO3为ymol
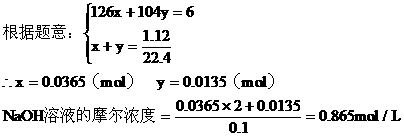
b:第二种情况:因NaOH过量,所以H2SO2完全反应。设参加反应的NaOH为amol,生成Na2SO3为bmol,过量的NaOH为Cmol
29.(11分)烧碱和氯气都是重要的基本化工原料,它们大多来自氯碱工业,氯碱工业的工艺流程如下图所示
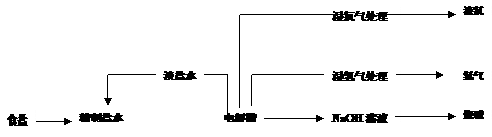
(1)电解饱和食盐水的总反应方程式为 ,阳极发生的电极反应为 。
(2)工业生产用的食盐水进入电解槽之前需精制,请简要说明精制的原因。
(3)目前氯碱工业主要采用的方法有三种,它们各有特点(见表)
|
方法 |
电解槽特点 |
产中中 氯化钠 含量 |
电解液中氢氧化钠含量 |
总耗能(KW.h上.t-1) |
其 他 |
|
隔膜法 |
使用石棉纤维制成的隔膜隔开阳极 |
较大 |
低 |
高 |
细微石棉吸入人的肺内有损健康,目前正被离子膜交换法取代 |
|
|
由独立的电解室和解汞室构成,氢气和氯气在不同室产生 |
低 |
很高 |
高 |
汞易对环境造成污染,在我国已被淘汰 |
|
|
使用能选择通过离子的离子膜替代隔膜法中石棉隔膜 |
很低 |
较高 |
低 |
占地少、生产能力大、能连续生产,是氯碱工业的发展方向。 |
请比较三种方法的优缺点,指出哪些方面的主要因素不断促进着电解槽革新?
(4)氯碱工业的选址比较特殊,如果通常不会单独建氯碱化工厂,而是与农药厂、有机化工厂、制药厂、盐酸厂等建在一起,请分析这种建厂方式的原因和所带来的好处。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com