
题目列表(包括答案和解析)
28.(08山东卷)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)===CH4(g)+HC≡CH(g)+H2(g);△H1=156.6 kJ·mol-1
CH3CH=CH2(g)===CH4(g)+HC=CH(g);△H2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g)===CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为___________;放电时,CO32-移向电池的_______(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(4)常温下,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是_______________________(用离子方程式和必要的文字说明)。
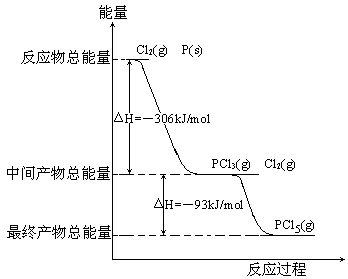
27.(08全国Ⅱ卷)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式_________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式_________________________________,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于_________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2_______α1(填“大于”、“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是________________________________________。
(4)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_______________________。
26.(05天津卷)磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
(2)已知单质磷的燃烧热为Y kJ/mol,则1mol P与O2反应生成固态P2O3的反应热ΔH= 。
(3)写出1mol P与O2反应生成固态P2O3的热化学方程式:
。
25.(03天津卷)已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A.H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
C.H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1
考点3 反应热的简单计算
24.(04广东卷)已知葡萄糖的燃烧热是2804kJ/mol,当它氧化生成1g水时放出的热量是
A.26.0kJ B.51.9kJ C.155.8kJ D.467.3kJ
23.(04全国卷)已知
(l)H2(g)+1/2O2(g)=H2O(g) △H1=a kJ·mol-1
(2)2H2(g)+O2(g)=2H2O(g) △H2=b kJ·mol-1
(3)H2(g)+1/2O2(g)=H2O(l) △H3=c kJ·mol-1
(4)2H2(g)+O2(g)=2H2O(l) △H4=d kJ·mol-1
下列关系式中正确的是
A. a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
22.(04全国卷)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是
A.CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=+725.8 kJ/mol
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452 kJ/mol
C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=+1452 kJ/mol
21.(05江苏卷)氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l); △H=-285.8 kJ / mol
CO(g)+1/2O2(g)=CO2(g); △H=-283.0 kJ / mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l); △H=-5518 kJ / mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l); △H=-890.3 kJ / mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是
A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)
20.(05全国卷)已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-4b kJ/mol
B.C2H2(g)+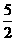 O2(g)=2CO2(g)+H2O(l);△H=2b
kJ/mol
O2(g)=2CO2(g)+H2O(l);△H=2b
kJ/mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-2b kJ/mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=b kJ/mol
19.(06江苏卷)下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)=CO2(g);△H1 C(s)+1/2O2(g)=CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4
③H2(g)+1/2O2(g)=H2O(l);△H5 2H2(g)+O2(g)=2H2O(l);△H6
④CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)=Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com