
题目列表(包括答案和解析)
6.(06天津卷)某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g)+Y(g)  Z(g)+W(s);△H>0
Z(g)+W(s);△H>0
下列叙述正确的是( )
A.加入少量W,逆反应速率增大 B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动 D.平衡后加入X,上述反应的△H增大
5.(06重庆卷)已知反应mX(g)+nY(g)  qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
4.(06全国卷)反应2A(g)+B(g) 2C(g);△H>0。下列的反应条件有利于生成C的是( )
2C(g);△H>0。下列的反应条件有利于生成C的是( )
A.低温、低压 B.低温、高压 C.高温、高压 D.高温、低压
3.(07全国卷II)已知:C(s)+CO2(g) 2CO(g);DH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是( )
2CO(g);DH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是( )
A.升高温度和减小压强 B.降低温度和减小压强
C.降低温度和增大压强 D.升高温度和增大压强
2.(07全国卷I)如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是( )
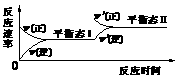
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态II
C.该反应达到平衡态I后,减小反应物浓度,平衡发生移动,达到平衡态II
D.同一种反应物在平衡态I和平衡态II时浓度不相等
1.(07北京卷)一定条件下,在体积为10 L的密闭容器中,1 mol X和1
mol Y进行反应:2X(g)+Y(g) Z(g),经60
s达到平衡,生成0.3 mol Z,下列说法正确的是( )
Z(g),经60
s达到平衡,生成0.3 mol Z,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的DH>0
20.(07山东卷)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g) 2SO3(g)。某温度下,SO2的平衡转化率()与体系总压强(p)的关系如图所示。根据图示回答下列问题:
2SO3(g)。某温度下,SO2的平衡转化率()与体系总压强(p)的关系如图所示。根据图示回答下列问题:
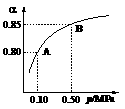
①将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于____________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g);DH =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g);DH =-1160 kJ/mol
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为_____________(阿伏加德罗常数的值用NA表示),放出的热量为_________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M = Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
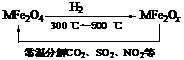
请写出MFe2Ox分解SO2的化学方程式______________________________________(不必配平)。
19.(07宁夏卷)氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:□SiO2+□C+□N2 □Si3N4+□CO
□Si3N4+□CO
(1) 配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应中的氧化剂是__________,其还原产物是_____________。
(3)该反应的平衡常数表达式为K =_______________________;
(4)将知上述反应为放热反应,则其反应热DH________零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值________(填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向_______反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v (CO) =18 mol/(L·min),则N2消耗速率为v (N2) =__________mol/(L·min)。
18.(07上海卷)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
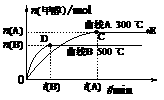
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)= 。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_______________________________________(用化学方程式表示)。
17.(07海南卷) PCl5的热分解反应为:PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
(1) 写出反应的平衡常数表达式:
(2) 已知某温度下,在容积为10.0 L的密闭容器中充入2.00 mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150 mol/L。计算该温度下的平衡常数。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com