
题目列表(包括答案和解析)
7.150时℃,碳酸铵加热分解产生的气体混合物,相同条件下对氢气的相对密度为( )
A.12 B.18 C.24 D.48
6.不能用勒夏特列原理解释的是( )
①红棕色的NO2加压后颜色先变深后变浅 ②由H2、I2、HI三种气体组成的平衡体系加压后颜色变深 ③黄绿色的氯水光照后颜色变浅 ④煅烧粉碎的硫铁矿有利于SO2生成 ⑤使用铁触媒,使N2和H2的混合气体有利于合成NH3
⑥高压比常压条件下有利于合成NH3 ⑦500℃左右比室温更有利于合成NH3⑧配制FeCl3溶液是将其溶于浓盐酸中再稀释 ⑨实验室常用排饱和食盐水法收集C12 ⑩热的纯碱溶液去油污效果更好
A.①③⑥⑧⑨⑩ B.①②④⑤⑦ C.②③⑤⑦⑧ D.②④⑤⑦
5.下列物质中,在一定条件下既能与某些金属单质反应,又能与某些非金属单质反应,既能与某些酸反应,还能与某些碱反应的是( )
①NaHSO4 ②NH4HCO3 ③H2SO3 ④C12
A.①②③ B.③ C.④ D.③④
4.有两种-元弱酸的钠盐溶液,其物质的量浓度相等。现向这两种盐的溶液中分别通入适量的CO2,发生的反应为:NaR+CO2+H2O=HR+NaHCO3;2NaR′+CO2+ H2O=2HR′+Na2CO3。则下列反应能发生的是( )
A.NaR+HR′=HR+NaR′ B.NaR+NaHCO3=HR+Na2CO3
C.NaR′+ NaHCO3=HR′+ Na2CO3 D.HR′+NaHCO3=NaR′+CO2+H2O
3.下列说法正确的是(NA为阿伏加德罗常数)( )
A.在1mol的Na2O2中,阴、阳离子皆有20NA个电子
B.在常温常压下,22.4LCH4和C4H8混合气体中,气体分子数少于NA
C.1mol NH4HSO4晶体中,阴、阳离子总数为3NA
D.1mol NO2溶于足量的水里,转移的电子数为NA
2.下列几种粒子:OH-、NH3、NH4+、Mg2+、H3O+,其中在溶液中能两两发生反
应的组数有( )。
A.4 B.5 C、6 D、7
1.下列实验或生产操作:①蛋白质溶液中加入硫酸铵生成沉淀,②二氧化氮经加压凝成无色液体,③石蜡催化裂化,④碘受热变成碘蒸气,⑤照相底片被感光,其中没有新物质生成的是( )
A.①④ B.②③ C、①③④⑤ D、①③④
25.(10分)过量的铁溶于稀硫酸可得硫酸亚铁。等物质的量的硫酸亚铁与硫酸铵作用,能生成溶解度较小的硫酸亚铁铵晶体[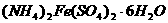 ,浅绿色晶体],该晶体的商品名称为摩尔盐。
,浅绿色晶体],该晶体的商品名称为摩尔盐。
(1)写出上述反应的化学方程式。
(2)若用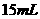
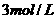 硫酸来制备摩尔盐,计算生成摩尔盐的质量。
硫酸来制备摩尔盐,计算生成摩尔盐的质量。
(3)为了测定某批次莫尔盐的纯度,取该产品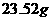 配成
配成 溶液,取出
溶液,取出 用
用
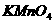 溶液滴定,消耗
溶液滴定,消耗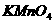 溶液
溶液 。
。
①配平下列反应式:
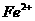
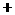
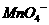
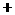
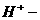
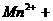
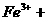
②试求产品中莫尔盐的质量分数 。
24.(14分)熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的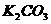 ,(其中不含
,(其中不含 和
和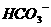 )为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:
)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为: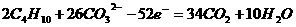 。试回答下列问题:
。试回答下列问题:
(1)该燃料电池的化学反应方程式为 ;
(2)正极电极反应式为 ;
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是 ,它来自 ;
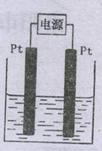 (4)某学生想用该燃料电池和右图所示装置来电解饱和食盐水。
(4)某学生想用该燃料电池和右图所示装置来电解饱和食盐水。
①写出反应的离子方程式 。
②将湿润的淀粉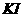 试纸放在该装置附近,发现试纸变蓝,
试纸放在该装置附近,发现试纸变蓝,
待一段时间后又发现蓝色褪去,这是因为过量的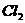 将生成的
将生成的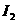
氧化。若反应的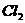 和
和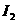 的物质的量之比为5:l,且生成两种
的物质的量之比为5:l,且生成两种
酸。该反应的化学方程式为 ;
③若电解后得到

 溶液,则消耗
溶液,则消耗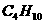 的体积在标准状况下为
的体积在标准状况下为
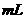 。
。
23.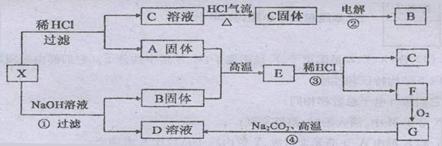 (12分)下图中X为中学化学中两种重要单质的混合物。A、G的均为原子晶体,F是正四面体结构的非极性分子,反应②、④是工业上的重要反应。图中部分反应的生成物及反应条件没有列出。
(12分)下图中X为中学化学中两种重要单质的混合物。A、G的均为原子晶体,F是正四面体结构的非极性分子,反应②、④是工业上的重要反应。图中部分反应的生成物及反应条件没有列出。
请回答:
(1)写出A和B的化学式:A ,B ;
(2)写出C溶液转化为C固体的过程中 气流的作用是
;
气流的作用是
;
(3)写出①、③和④反应的化学方程式:
① ;
③ ;
④ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com