
题目列表(包括答案和解析)
15.(3分)下列有关实验的叙述中,正确的是 ▲ (填序号)。
①将浓氨水逐滴滴入装有生石灰的烧瓶中,可以制取氨气。
②配制一定物质的量浓度的NaCl溶液时,定容后摇匀,发现液面又低于刻度线,此时无须再加入蒸馏水。
③用小刀切取少量金属钠做实验,切剩的钠要立即放入原试剂瓶。
④分液漏斗分液时,先将下层的液体从下口流出,然后再从下口流出上层的液体
⑤测定某溶液pH时,取一小块干燥的试纸放入玻璃片上,用玻璃棒蘸取溶液滴在试纸的中部,再与pH试纸比色卡对比
⑥配制氯化铁溶液时,先将氯化铁固体加入盐酸中溶解,然后加水稀释;
⑦向100℃时的NaOH稀溶液中滴加饱和的FeCl3溶液,以制备Fe(OH)3胶体;
⑧向试管中滴加液体时,为不使液体滴到试管外应将胶头滴管伸入试管中;
⑨配置100 mL 1.00mol/L的NaCl溶液时,可用托盘天平称取5.85 gNaCl固体;
14.在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:
 2A(?)+ B(?) xC(g) ΔH<0
2A(?)+ B(?) xC(g) ΔH<0
平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是 ( )
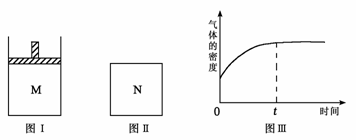
A.x =4
B.若N中气体的密度如图Ⅲ所示,则A、B有一种是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
第Ⅱ卷(非选择题 共72分)
13.今有室温下四种溶液,有关叙述不正确的是 ( )
|
|
① |
② |
③ |
④ |
|
pH |
11 |
11 |
3 |
3 |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH ①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.VaL④与VbL②溶液混合后,若混合后溶液pH=4, 则Va ∶Vb= 11∶9
12.下列有关说法正确的是 ( )
A.SO2(g)+H2O(g)→H2SO3(l),该过程熵值增大
B.SO2(g) →S(s)+O2(g)△H>0,△S<0该反应能自发进行
C.已知热化学方程式2SO2
(g)+O2 (g)  2SO3 (g);△H=-Q kJ·mol-1(Q>0),
2SO3 (g);△H=-Q kJ·mol-1(Q>0),
则将2mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出QkJ的热量
D.1mol NaOH分别和1mol CH3COOH、1molHNO3反应,后者比前者放出的热量多
11.同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的
是 ( )
A.2Na218O2 + 2H2O = 4Nal8OH + O2↑
B.2KMnO4 + 5H218O2 + 3H2SO4 = K2SO4 + 2MnSO4 + 518O2↑+ 8H2O
C.NH4Cl + 2H2O NH3·2H2O + HCl
NH3·2H2O + HCl
D.K37ClO3 + 6HCl = K37Cl + 3Cl2↑+ 3H2O
10.元素X的单质及X与Y形成的化合物能按如下图所示的关系发生转化。则X为
( )
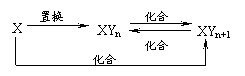

A.当n=1时,X可能是C B.当n=1时,X可能是N2
C.当n=2时,X可能是S D.当n=2时,X可能是Fe
9.下列离子方程式正确的是 ( )
A.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
B.Ca(HCO3)2与过量Ca(OH)2溶液反应:
Ca2++2HCO3-+2OH- = CaCO3↓+CO32-+2H2O
C.高锰酸钾与乙醇制备Mn3O4纳米粉体,同时生成乙醛:
6MnO4-+13CH3CH2OH→2Mn3O4+13CH3CHO+6OH-+10H2O
D.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S↑
8.A、B、C、D都是短周期元素,原子半径:D>C >A >B。已知A、B同周期,A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍。下列说法中正确的是 ( )
A.A、C两元素处在元素周期表中的第ⅥA族
B.B、C、D三种元素可组成化学式为DCB2的化合物
C.B、D两元素组成的化合物中阴、阳离子的个数比为1∶1
D.B、C、D三种元素的简单离子的半径大小顺序为:C > D > B
7.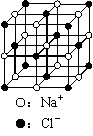 用6.02×1023表示阿伏加德罗常数的值,下列说法中正确的是( )
用6.02×1023表示阿伏加德罗常数的值,下列说法中正确的是( )
A.T℃时,1 L pH=6纯水中,含10-6NA个OH-
B.6.8 g熔融的KHSO4中含有6.02×1022个阳离子
C.23.4 g NaCl晶体中含有1.204×1023个右图所示的结构单元
D.用含有0.1molFeCl3的饱和溶液制得的氢氧化铁胶体中,
胶粒数等于0.1 NA
6.
 反应H2(g)+I2(g)
2HI(g)的平衡常数为K1;反应HI(g)
1/ 2H2(g)+ 1/2I2(g)的平衡常数为K2,则K1、K2的关系为(平衡常数为同温度下的测定值)
( )
反应H2(g)+I2(g)
2HI(g)的平衡常数为K1;反应HI(g)
1/ 2H2(g)+ 1/2I2(g)的平衡常数为K2,则K1、K2的关系为(平衡常数为同温度下的测定值)
( )
A.K1= 2K2 B.K1= K22 C.K1 =1/K22 D.K1= 1/2K2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com