
题目列表(包括答案和解析)
3. 下列过程需要通电才可进行的是:①电离 ②电解 ③电镀 ④电泳 ⑤电化腐蚀
A.①②③ B.②③④ C.②④⑤ D.①②③④⑤
2. 分类方法在化学学科的发展中起了非常重要的作用。下图是某反应在密闭容器中反应前后的分子状况示意图,·和○分别表示不同的原子。对此反应的分类不正确的是
A.化合反应
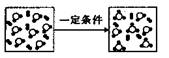 B.氧化还原反应
B.氧化还原反应
C.可逆反应
D.置换反应
1.以下说法正确的是
A 纳米材料是指一种称为“纳米”的新物质制成的材料
B 绿色食品是指不含任何化学物质的食品
C 生物固氮是指植物通过叶面直接吸收空气中的氮气
D 光导纤维是以二氧化硅为主要原料制成的
22.(10分)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
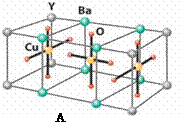 NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。
NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。
试回答下列问题:
(1)基态氮原子核外电子排布的轨道表示式为_______________▲_______________。
(2)元素N、S、P的第一电离能(I1)由大到小的顺序为__ ___ ▲_ 。
(3)HN3属于_____▲______晶体,N3-的空间构型是__▲ __,与N3-互为等电子体的分子的化学式为______▲_____(写1种)。NH2-的电子式为_____▲______,其中心原子的杂化类型是_____▲______。
(4)CuCl2-中的键型为_____▲______,超导氧化物A的化学式为_____▲______。
(5)治癌药物B的结构简式为________▲_________。
21.(7分)硫酸银的溶解度较小,25℃时,每100 g水仅溶解0.836 g。
(1) 25℃时,在烧杯中放入6.24 g硫酸银固体,加200 g水,经充分溶解后,所得饱和溶液的体积为200 mL。计算溶液中Ag+的物质的量浓度。▲
(2) 若在上述烧杯中加入50 mL 0.0268 mol / L BaCl2溶液,充分搅拌,溶液中Ag+的物质的量浓度是多少?▲
(3) 在(1)题烧杯中需加入多少升0.0268 mol / L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200 mol / L?▲
20.(12分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:
|
物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
|
溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |
该工艺的主要流程如下。
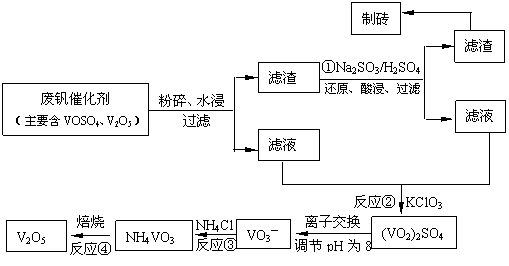 请回答下列问题:
请回答下列问题:
(1)23V在元素周期表位于第 ▲ 周期 ▲ 族。工业上由V2O5 冶炼金属钒常用铝热剂法,其用化学方程式表示为 ▲ 。
(2)反应①的目的是 ▲ 。
(3)该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,写出该步发生反应的离子方程式 ▲ 。
(4)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量: VO2+ + H2C2O4 + H+ → VO2+ + CO2 + ______。
短线上填写物质的化学式或离子符号后,写出配平后完整的离子方程式。
▲ 。
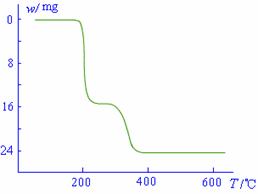 (5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如右图所示。则NH4VO3在分解过程中 ▲ 。
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如右图所示。则NH4VO3在分解过程中 ▲ 。
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
19.(15分)如图装置中,E为一只盛有AlCl3溶液的表面皿,C为铂棒、D为铁棒,X与Y为电源的电极,A、B中插入多孔的惰性电极。切断开关K1,闭合开关K2,通直流电一端时间后,A、B中液面如图所示,请回答 :
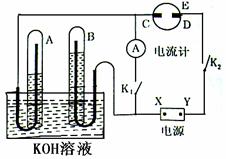 ⑴标出电源的正、负极,X为____▲____, Y为___▲______。
⑴标出电源的正、负极,X为____▲____, Y为___▲______。
⑵写出电极反应:
A中:______________▲_ _____________
B中:______________▲______________
C中:______________▲_ ____________
D中:______________▲__ _____________
(3)电解AlCl3溶液时,下图所示的电解变化曲线合理的是( ▲ )(忽略表面皿阳极产生气体与溶液的反应)

A.①④ B.②④ C.②③ D.①③
(4)电解AlCl3溶液时,若产生沉淀1.56g时, 将A极产生的气体在常温下燃烧,生成液态水,放出8.574KJ热量,写出其燃烧热的热化学方程式.
▲
⑸若电解一段时间后,A、B中均有气体包围(两玻璃管中液面未脱离电极),此时切断开关K2,闭合开关K1,则电流指针__▲____ (是或否)偏转.若偏转写出电极反应:
A中:____________________▲____________________ __
B中:____________________▲______________________________
⑹若把A气体换为甲醇,此时切断开关K2,闭合开关K1,则电流指针也偏转.写出电极反应:
A中: _________________▲____________________________
18.(7分)将NaBiO3固体(黄色微溶)加入MnSO4和H2SO4的混合溶液里加热,发生如下反应:
[ ]NaBiO3+[ ]MnSO4+[ ]H2SO4→[ ]Na2SO4+[ ]Bi2(SO4)3+[ ]NaMnO4+[ ]H2O
(1)配平上述反应的化学方程式:▲
(2)上述反应中被氧化的元素是______▲____,若有2mol氧化剂在该反应中被还原,则生成的MnO4-被还原为Mn2+时,能将___▲____molHCl氧化成Cl2。
(3)写出NaBiO3固体溶于HCl时发生反应的离子方程式____ ▲ ________。
17.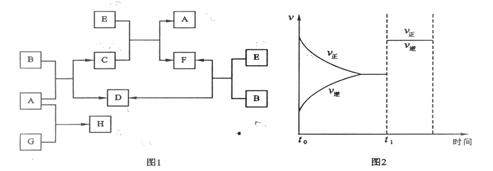 (9分)下列图1中B是一种常见的无色无味的液体。C是一种有磁性的化合物,E是一种无色无味的有毒气体。根据下列图1、图2,回答下列问题:
(9分)下列图1中B是一种常见的无色无味的液体。C是一种有磁性的化合物,E是一种无色无味的有毒气体。根据下列图1、图2,回答下列问题:
(1)写出C的化学式: ▲ 。
(2)在101kPa和150℃时,可逆反应E(g) + B(g) F(g) + D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是 ▲ (填选项字母)。 A.升高温度 B.增大压强 C.加入催化剂
F(g) + D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是 ▲ (填选项字母)。 A.升高温度 B.增大压强 C.加入催化剂
(3)若G是一种淡黄色固体单质,16 g G和足量的A反应放出的热量为Q kJ(Q > 0),写出这个反应的热化学方程式: ▲ 。
若G是一种气态单质,H的水溶液可以和有机物I反应使溶液呈紫色,请写出I的结构简式: ▲ ;H的水溶液呈酸性,请用离子方程式表示呈酸性的原因: ▲ 。
16.(9分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称取a g样品,置于烧杯中;
② 加适量盐酸和适量蒸馏水使样品溶解,准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。
请根据上面叙述,回答:

(1)上图仪器中,实验步骤①②③中必须用到的仪器是E和 ▲ (填仪器序号)
(2)写出步骤③中发生反应的离子方程式 ▲
(3)洗涤沉淀的操作是 ▲
(4)若坩埚质量是W1 g,最终坩埚和固体的总质量是W2 g,则样品中铁元素的质量分数为
▲
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com